Metabolismo del ferro: una ricerca del San Raffaele scopre un nuovo meccanismo di regolazione
Esistono due malattie, la FOP e la PAH, che nonostante presentino manifestazioni cliniche diverse, condividono alcuni aspetti comuni che potrebbero permettere lo sviluppo di potenziali terapie farmacologiche per altre patologie.
A spiegarci la ricerca, pubblicata sulla prestigiosa rivista scientifica “Blood”, è la Dott.ssa Silvia Colucci, prima autrice dell’articolo, ex studentessa di Biotecnologie presso il nostro Ateneo e attualmente PhD student ad Heidelberg, in Germania, nel gruppo di Iron Homeostasis del Molecular Medicine Partnership Unit (MMPU).
DA DOVE NASCE L’IDEA DI QUESTA RICERCA
“Questa ricerca” racconta la Dott.ssa Colucci “è nata da un’idea della Dott.ssa Laura Silvestri, Project leader dell’Unità “Regolazione del metabolismo di ferro” (coordinata dalla Prof.ssa Clara Camaschella), e correlatrice durante il mio internato di tesi magistrale. In seguito ad uno studio molto approfondito ed a un’ottima intuizione, è riuscita a ricomporre pezzi di un puzzle che all’inizio sembravano assolutamente non correlati”.
La FOP e la PAH di cui parlavamo all’inizio sono sigle per indicare rispettivamente la fibrodisplasia ossificante progressiva (FOP) l’ipertensione polmonare arteriosa (PAH). “Entrambe hanno un aspetto in comune: un’alterazione della via di segnale BMP-SMAD”.
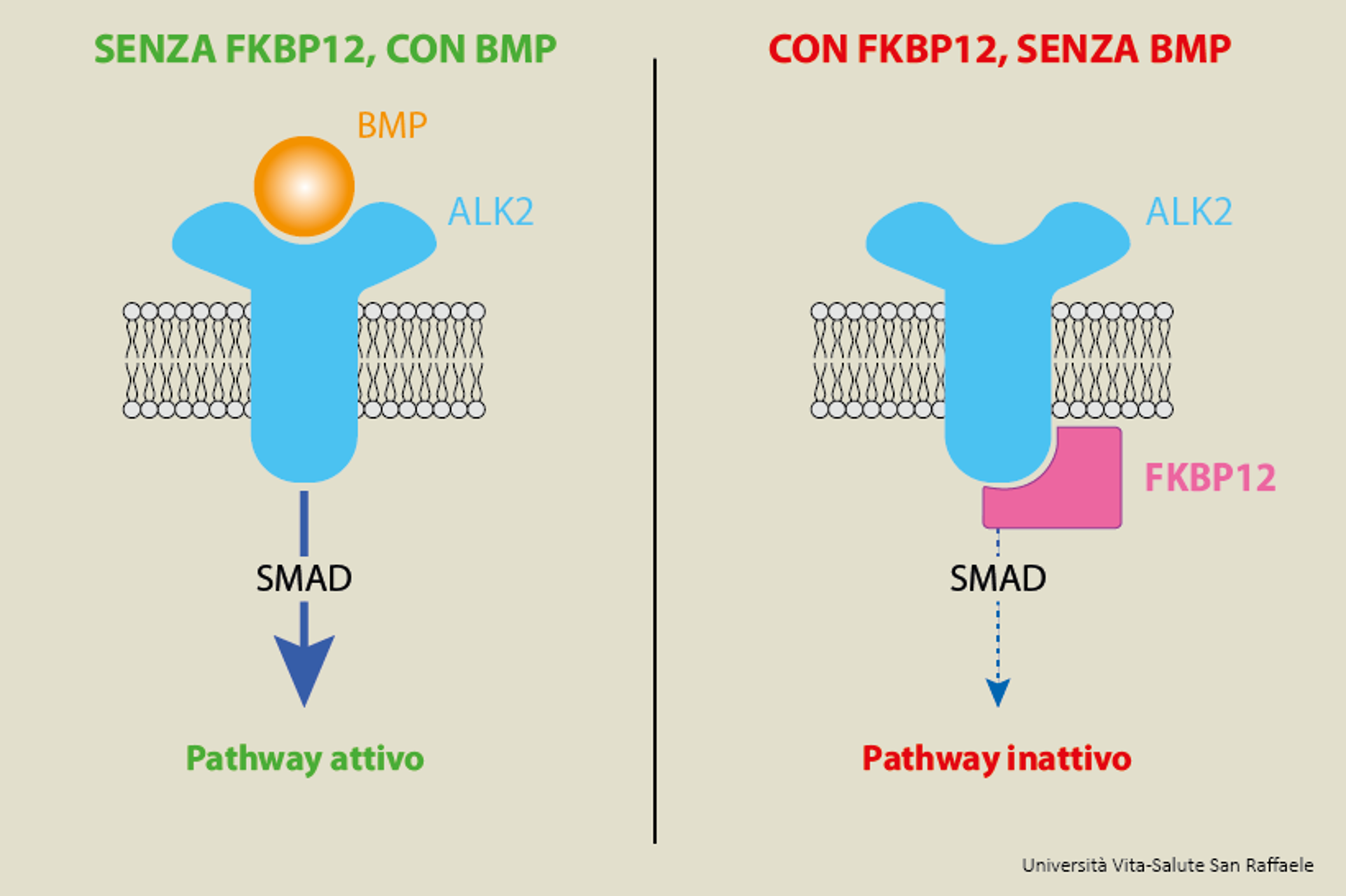
Di cosa si tratta?
“BMP” (che sta per bone morphogenetic proteins) è il nome di un gruppo di molecole che possono svolgere diverse funzioni. Quando interagiscono con il recettore ALK2 posto sulla membrana di alcune cellule, danno origine a una cascata di segnali (che coinvolgono anche una molecola chiamata SMAD) che producono un certo effetto.
“Il meccanismo di segnale BMP-SMAD è di estrema importanza nel campo del metabolismo del ferro, perché regola l’espressione dell’epcidina, un ormone prodotto dal fegato in grado di modulare l’assorbimento e la redistribuzione di ferro a tutto l’organismo. Un’inappropriata regolazione di epcidina può causare carenza di ferro, e quindi anemia, o sovraccarico di ferro che può essere estremamente tossico per tutti gli organi del nostro corpo. Identificare un meccanismo in grado di modulare epcidina è dunque di particolare importanza, perché permetterebbe l’utilizzo di nuovi approcci terapeutici per migliorare alcune condizioni patologiche dovute proprio ad una erronea regolazione di questo ormone”.
IN COSA CONSISTE LO STUDIO?
Nel meccanismo di segnale compare un altro protagonista che gioca un ruolo fondamentale: “FKBP12 è una proteina in grado di legare i recettori del complesso BMP-SMAD, in particolare ALK2, inibendoli: nella nostra ricerca ci siamo chiesti se FKBP12 potesse essere coinvolto nella modulazione del segnale BMP-SMAD nel fegato e quindi nella regolazione dei livelli di epcidina”.
Due sono stati gli approcci sperimentali adottati: “Abbiamo generato delle forme mutate di ALK2 incapaci di interagire con FKBP12, ed abbiamo utilizzato diversi farmaci (tacrolimus, rapamicina e GPI-1046) in grado di interagire con FKBP12 e di sfavorire la sua interazione con ALK2”.
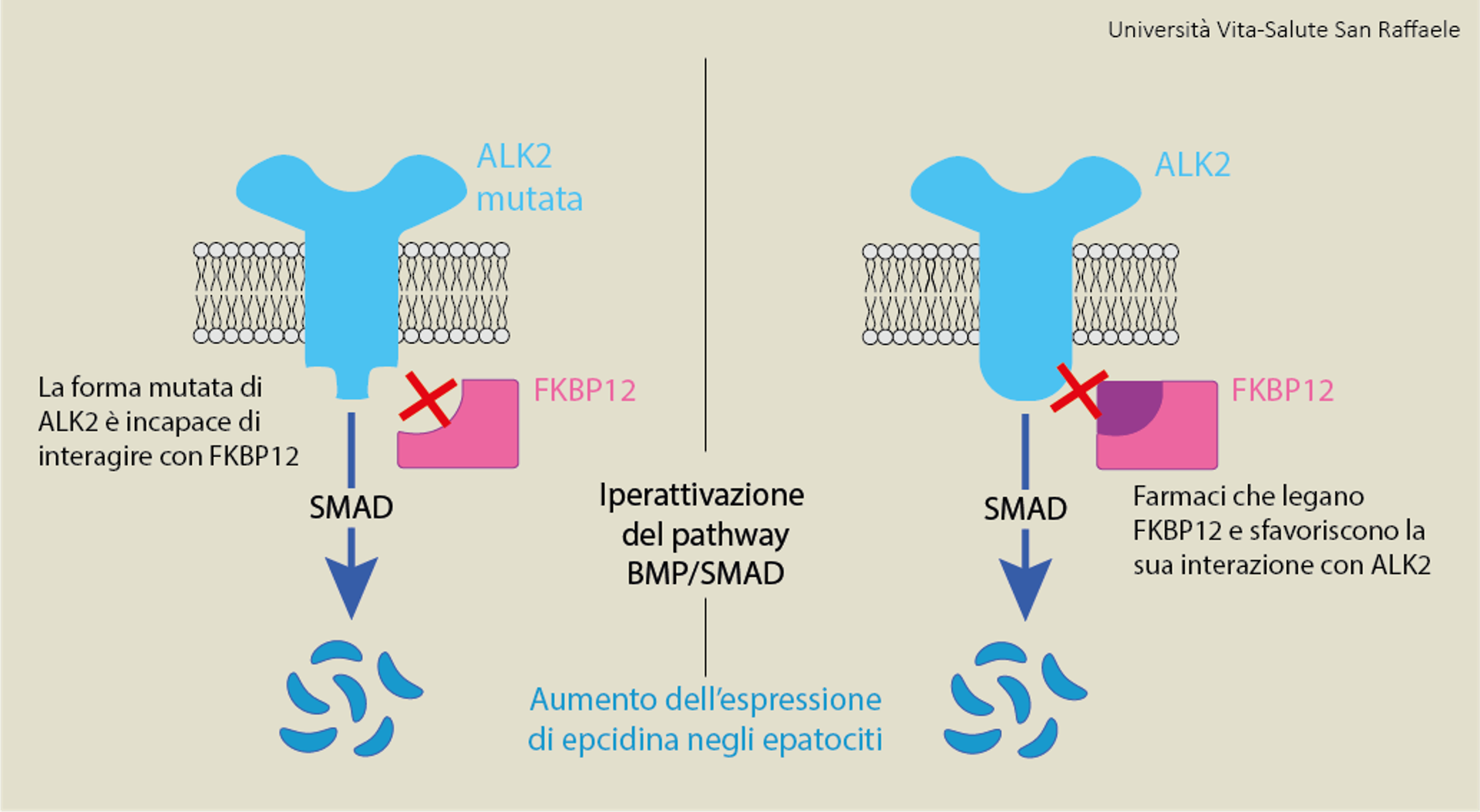
“Con entrambi gli approcci abbiamo ottenuto un aumento nell’espressione di epcidina, dovuta ad attivazione del pathway BMP-SMAD” racconta Colucci, “come confermato da studi che abbiamo condotto sia su linee di epatoma umano [tumore del fegato, N.d.R.] sia su epatociti [cellule del fegato, N.d.R.] primari di topo”. Il lavoro ha dunque dimostrato che FKBP12, interagendo con ALK2, può modulare l’attività del pathway BMP-SMAD e quindi l’espressione di epcidina in epatociti.
POTENZIALI IMPLICAZIONI CLINICHE DELLO STUDIO
Le potenziali implicazioni cliniche conseguenti all’identificazione di un nuovo regolatore di epcidina sono diverse e rilevanti. “Livelli bassi di epcidina sono responsabili di patologie che portano a sovraccarico di ferro e danno funzionale a diversi organi come fegato, cuore, pancreas, che può risultare fatale se non controllato adeguatamente. Due patologie tipicamente rappresentative di questa condizione sono l’emocromatosi e la β-talassemia. L’attuale approccio terapeutico, che per queste patologie è mirato a ridurre la quantità totale di ferro nell’organismo, non corregge il difetto primario, cioè la ridotta produzione di epcidina”. Evidenzia la Dott.ssa Colucci: “Nel caso dell’emocromatosi la terapia d’elezione è la flebotomia, cioè la rimozione di una certa quantità di sangue (e quindi di ferro) dal paziente. Nel caso della β-talassemia si opera con una somministrazione continua di chelanti del ferro che permettono all’elemento di essere escreto. Entrambe le terapie però non sono applicabili a tutti i pazienti per problemi di tolleranza (nel caso della flebotomia) o di tossicità ed effetti indesiderati, nel caso del chelante.

L’utilizzo di farmaci in grado di interferire o ridurre l’interazione di FKBP12 con ALK2 e di aumentare la sintesi di epcidina via attivazione del pathway BMP-SMAD potrebbe essere di grande aiuto per questi pazienti per i quali la terapia andrebbe a correggere il difetto primario. Esistono già in commercio dei farmaci che legano e sequestrano FKBP12 (gli immunosoppressivi tacrolimus e rapamicina): per questi farmaci potrebbe essere possibile una strategia di “drug repurposing” [“riposizionamento del farmaco”, cioè l’eventuale utilizzo di un farmaco già noto, a beneficio di sintomatologie diverse da quelle descritte in etichetta, N.d.R.]”.
DOTTORATO CON “METODO” UNISR
Chiediamo infine a Silvia in che modo UniSR abbia fornito le competenze e gli strumenti per perseguire un dottorato all’estero. “L’aspetto più rilevante che mi ha permesso di poter affrontare un dottorato (non necessariamente all’estero) è che durante gli anni universitari penso di aver appreso come bisogna approcciarsi ai problemi scientifici. Oltre alle nozioni di base infatti, il grande insegnamento che ho ricevuto è stato il metodo con cui affrontare lo studio di un aspetto della scienza che ci interessa. Altro elemento essenziale è stato sicuramente l’internato di tesi, che nel nostro Ateneo dura un minimo di 12 mesi. Il fatto di far parte attivamente di un laboratorio è stato per me di fondamentale importanza. Devo ringraziare la Prof.ssa Clara Camaschella, la Dott.ssa Laura Silvestri e tutti i colleghi dell’Unità di “Regolazione del Metabolismo del Ferro” per avermi insegnato come si lavora e per avermi trasmesso quanto sia bello e sempre stimolate questo lavoro”.
You might be interested in

World Rare Disease Day: Research at UniSR Continues All Year Round

Multiple sclerosis, breakthrough in research: researchers have identified a molecule that promotes repair of the nervous system
The microbiome as an ally against myeloma

