Malattie da accumulo di ferro cerebrale: un coenzima per “correggere” i neuroni malati
LA PROF.SSA LEVI DI UNISR CI SPIEGA LA SUA RICERCA, PUBBLICATA SULLA PRESTIGIOSA RIVISTA INTERNAZIONALE "EMBO MOLECULAR MEDICINE"
La storia
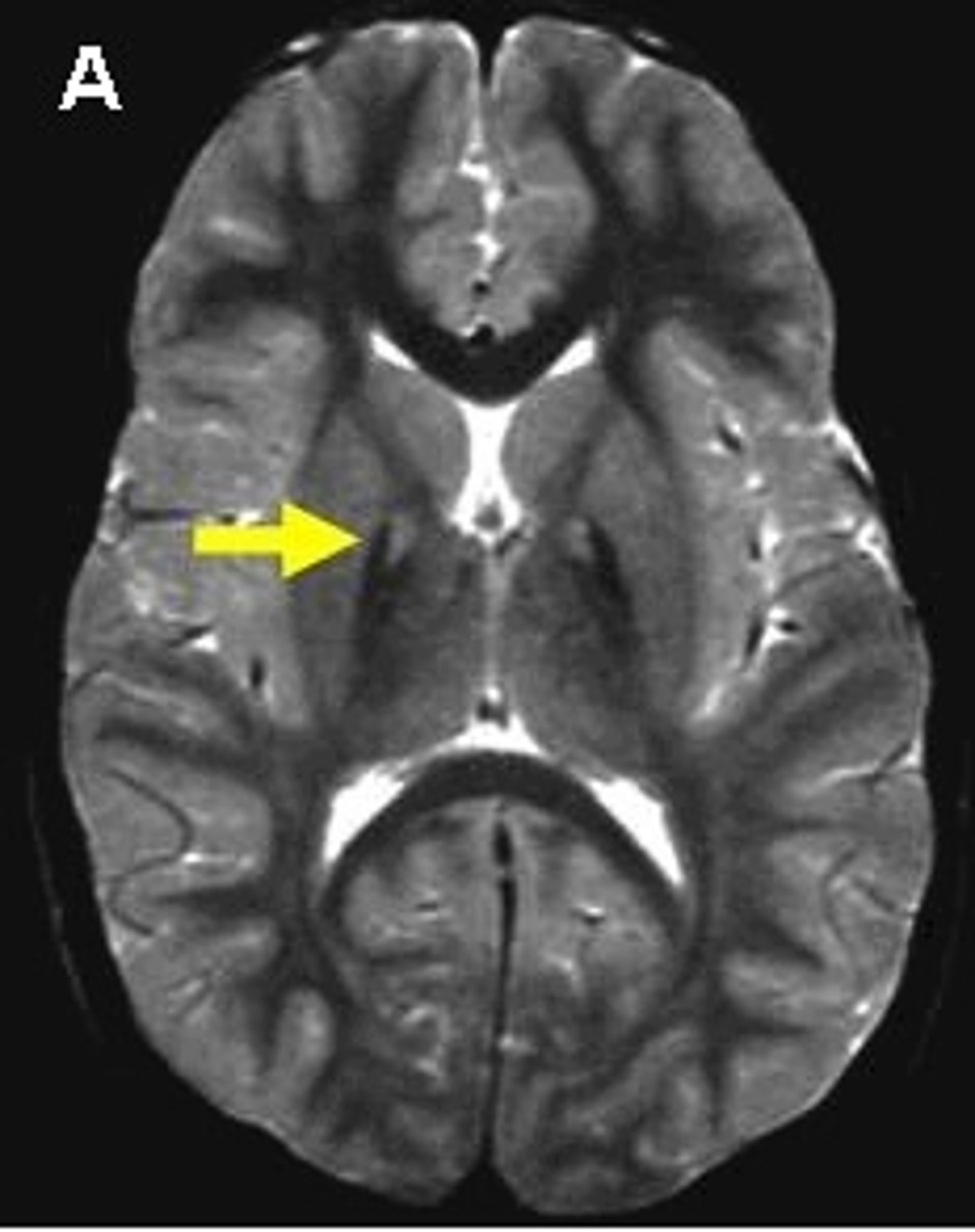
Forse in pochi lo sanno, ma esiste un gruppo di patologie chiamato NBIA (neurodegeneration with brain iron accumulation, letteralmente “neurodegenerazione con accumulo cerebrale di ferro”). Si tratta di patologie rare, che colpiscono poche persone nel mondo, che danno un grave accumulo di ferro in regioni specifiche del cervello, specialmente le aree che controllano il corretto movimento. Tra le NBIA ce n’è una in particolare, chiamata PKAN, che è diventata oggetto di uno studio congiunto tra l’Università Vita-Salute San Raffaele e l’Istituto Neurologico Carlo Besta, punto di riferimento in Italia per i pazienti che soffrono di questa malattia. La PKAN è una malattia grave che colpisce soprattutto i bambini, classificata come “malattia orfana” perché al momento non sono disponibili cure per fermare o ritardare il processo patologico. Oggi i medici possono identificare subito la malattia, perché una caratteristica distintiva è la presenza dell’“occhio di tigre”, visibile in risonanza magnetica.
Qual è la causa di questa malattia?
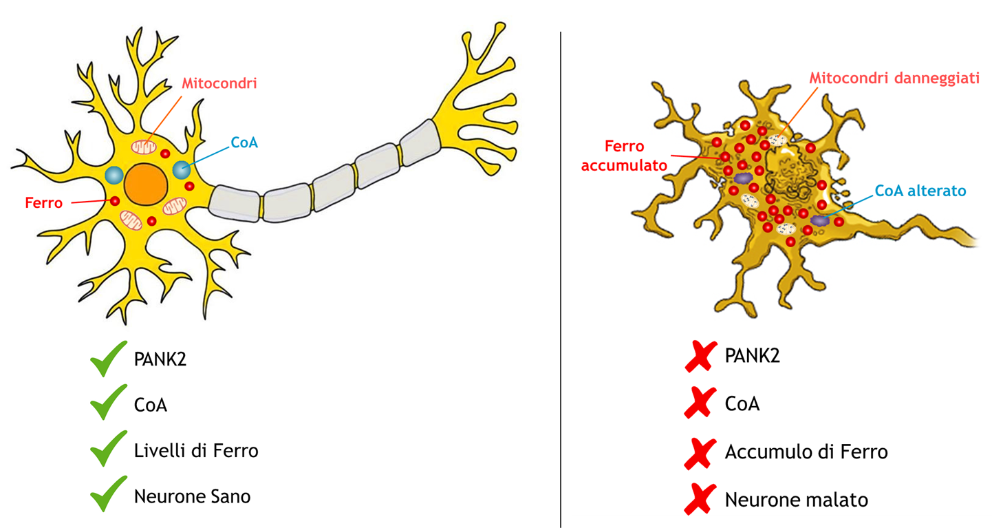
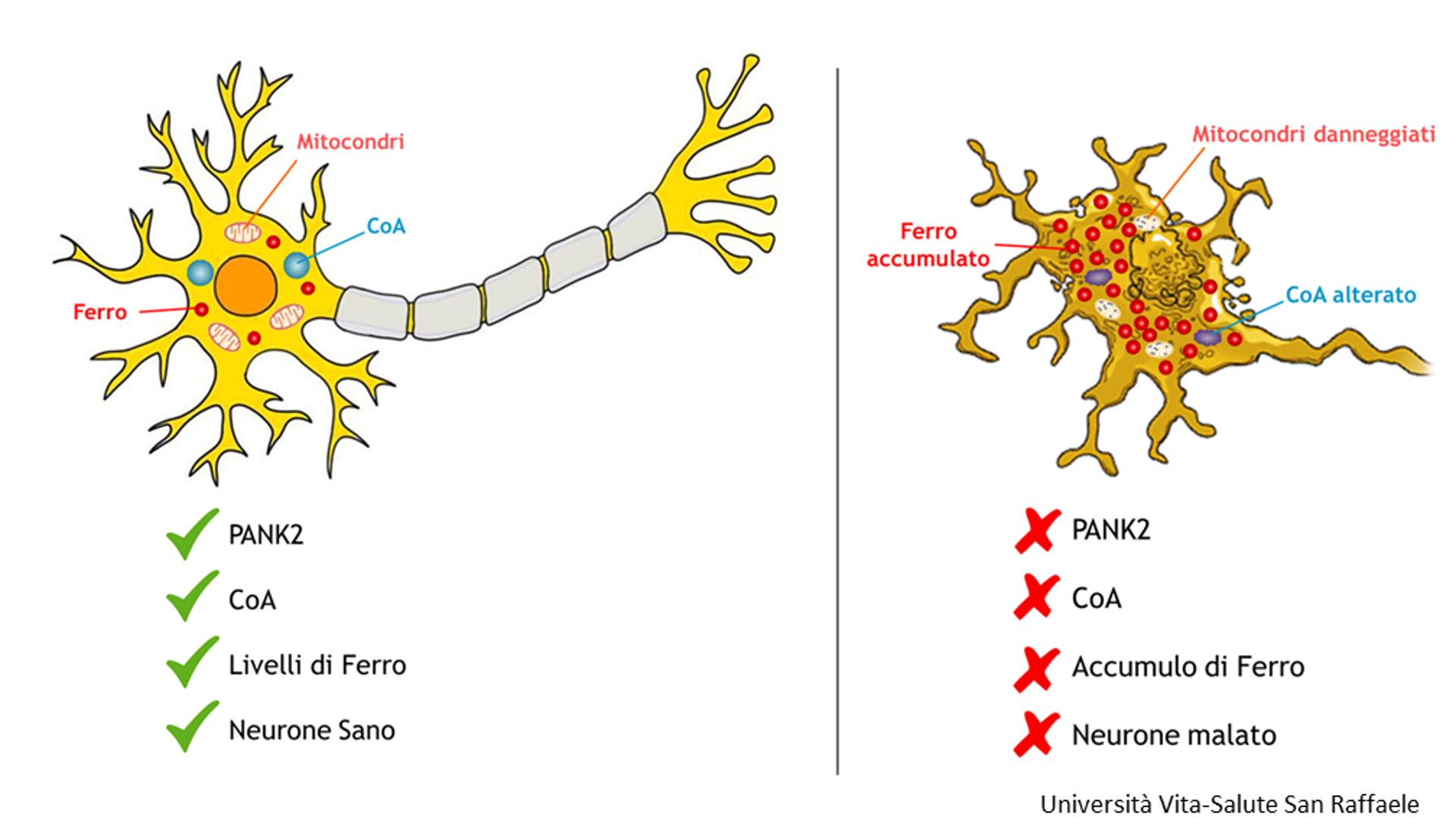
PKAN è causata da mutazioni nell’enzima PANK2, fondamentale per produrre la molecola Coenzima A (CoA).
CoA è una molecola chiave del nostro organismo, coinvolta in centinaia di processi biologici, ma non è ancor a chiaro come la sua alterazione interferisca con il metabolismo del ferro. Se PANK2 funziona bene, CoA sarà prodotto correttamente, i livelli di ferro neuronale saranno nella norma e il neurone sarà sano. Se PANK2 non funziona bene (o non funziona affatto), anche la produzione di CoA sarà compromessa, con conseguente accumulo di ferro nel cervello, tipico di questa malattia.
a chiaro come la sua alterazione interferisca con il metabolismo del ferro. Se PANK2 funziona bene, CoA sarà prodotto correttamente, i livelli di ferro neuronale saranno nella norma e il neurone sarà sano. Se PANK2 non funziona bene (o non funziona affatto), anche la produzione di CoA sarà compromessa, con conseguente accumulo di ferro nel cervello, tipico di questa malattia.
Lo studio
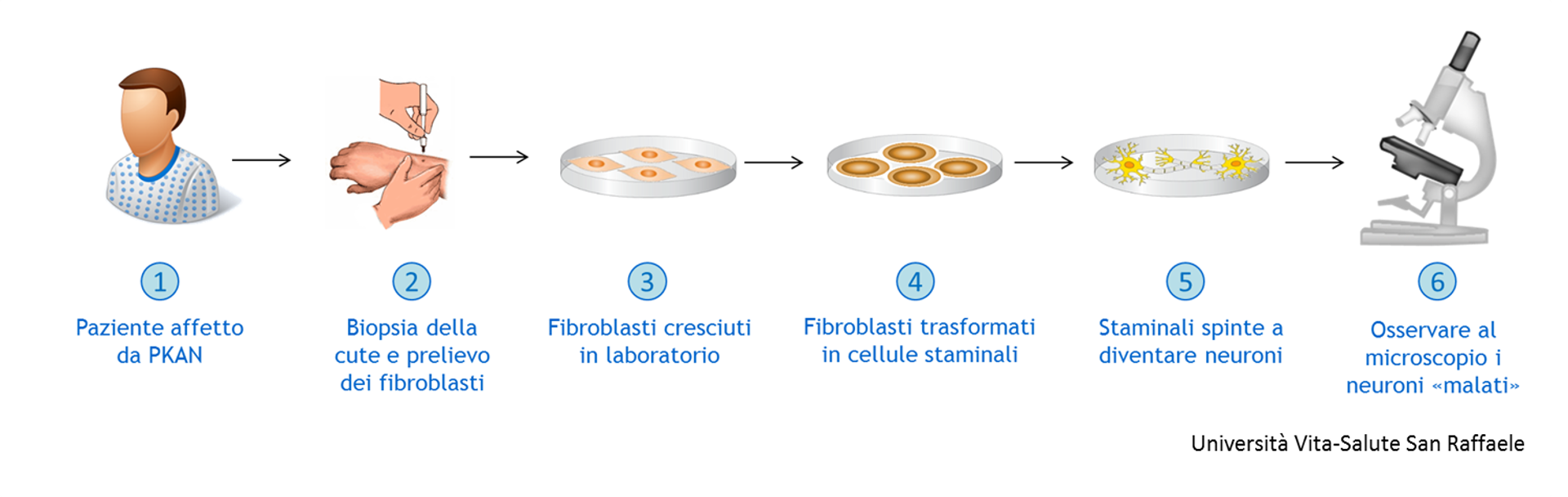
Per questo studio, i modelli animali non sono stati molto utili, perché non sono in grado di sviluppare i gravi accumuli di ferro che invece si vedono nella patologia umana. Perciò, i ricercatori sono andati a studiare i neuroni dei pazienti affetti, con una tecnica affascinante: la generazione di cellule staminali pluripotenti indotte. Lo schema dell’esperimento è questo:
- Trovare dei pazienti affetti da PKAN
- Effettuare una biopsia della cute da cui derivare i fibroblasti (cellule del tessuto connettivo)
- Far crescere i fibroblasti in laboratorio
- Trasformarli in cellule staminali (cioè cellule che possono diventare qualsiasi tipo cellulare)
- Spingere queste cellule staminali a diventare neuroni
- Osservare il comportamento di questi neuroni PKAN “malati”

Proprio come i pazienti da cui sono stati ottenuti, i neuroni PKAN presentano danni a carico di PANK2 e CoA e dimostrano gravi problemi di funzionalità: disfunzioni dei mitocondri, ridotta produzione di energia, difetti nella membrana, che non sa più condurre l’elettricità, ma soprattutto alterata gestione del ferro a livello del mitocondrio, con conseguente accumulo di ferro cellulare. In modo sorprendente, i ricercatori hanno scoperto che è sufficiente somministrare il CoA a questi neuroni per recuperare la loro funzionalità!
I risultati
Questo studio è importante per diverse ragioni:
- Tra tutte le NBIA, questo è il primo modello neuronale umano ottenuto in laboratorio
- Il modello neuronale è uno strumento importante per comprendere i meccanismi fisio-patologici della malattia
- Inoltre suggerisce che un supplemento di CoA potrebbe essere un potenziale trattamento terapeutico per la patologia
Quali prospettive si aprono adesso? L’abbiamo chiesto alla Professoressa Levi, coordinatrice dello studio, docente di Biologia Applicata presso l’Università Vita-Salute San Raffaele e Responsabile dell’Unità Proteomica del Metabolismo del Ferro: “Questo studio indica che il trattamento con il CoA rappresenta un possibile approccio terapeutico. Ad oggi il CoA non è ancora stato sperimentato come agente curativo in questi pazienti. Le nostre ricerche future saranno focalizzate su studi condotti, sia su modelli cellulari che animali, per la comprensione del dosaggio necessario e per stabilirne l’effettivo vantaggio terapeutico”.
L’articolo completo è disponibile qui: http://onlinelibrary.wiley.com/doi/10.15252/emmm.201606391/full
You might be interested in

Multiple sclerosis, breakthrough in research: researchers have identified a molecule that promotes repair of the nervous system
The microbiome as an ally against myeloma

Intrecci: a UniSR project for more inclusive and accessible cancer diagnosis