HMGB1 è una proteina dalle mille facce. Normalmente presente nel nucleo delle cellule (dove si lega al DNA, ne promuove la riparazione e la trascrizione dei geni), in condizioni di stress cellulare può essere rilasciata nel citoplasma o fuori dalla cellula, dove svolge molte funzioni diverse, forse non ancora tutte identificate.
Quando un tessuto subisce un danno, i processi di infiammazione – mediata dal sistema immunitario – e successiva rigenerazione del tessuto sono fondamentali per la guarigione. In una ricerca pubblicata su The Journal of Experimental Medicine, un gruppo di ricercatori ha identificato in HMGB1 la proteina chiave nel governare entrambi i processi. Non solo: modificando HMGB1 in laboratorio ne hanno creato una versione che agisce solo in chiave rigenerativa. La nuova proteina, chiamata 3S-HMGB1, si è dimostrata capace di accelerare il processo di ricostruzione del tessuto in topi che presentavano un danno ai muscoli o al fegato. Lo studio è stato coordinato dai Dottori Emilie Vénéreau e Mario Tirone, ricercatori presso l’Unità “Dinamica della cromatina” dell’Ospedale San Raffaele, e dal Prof. Marco Bianchi, Ordinario di Biologia Molecolare presso il nostro Ateneo e Capo della stessa Unità.
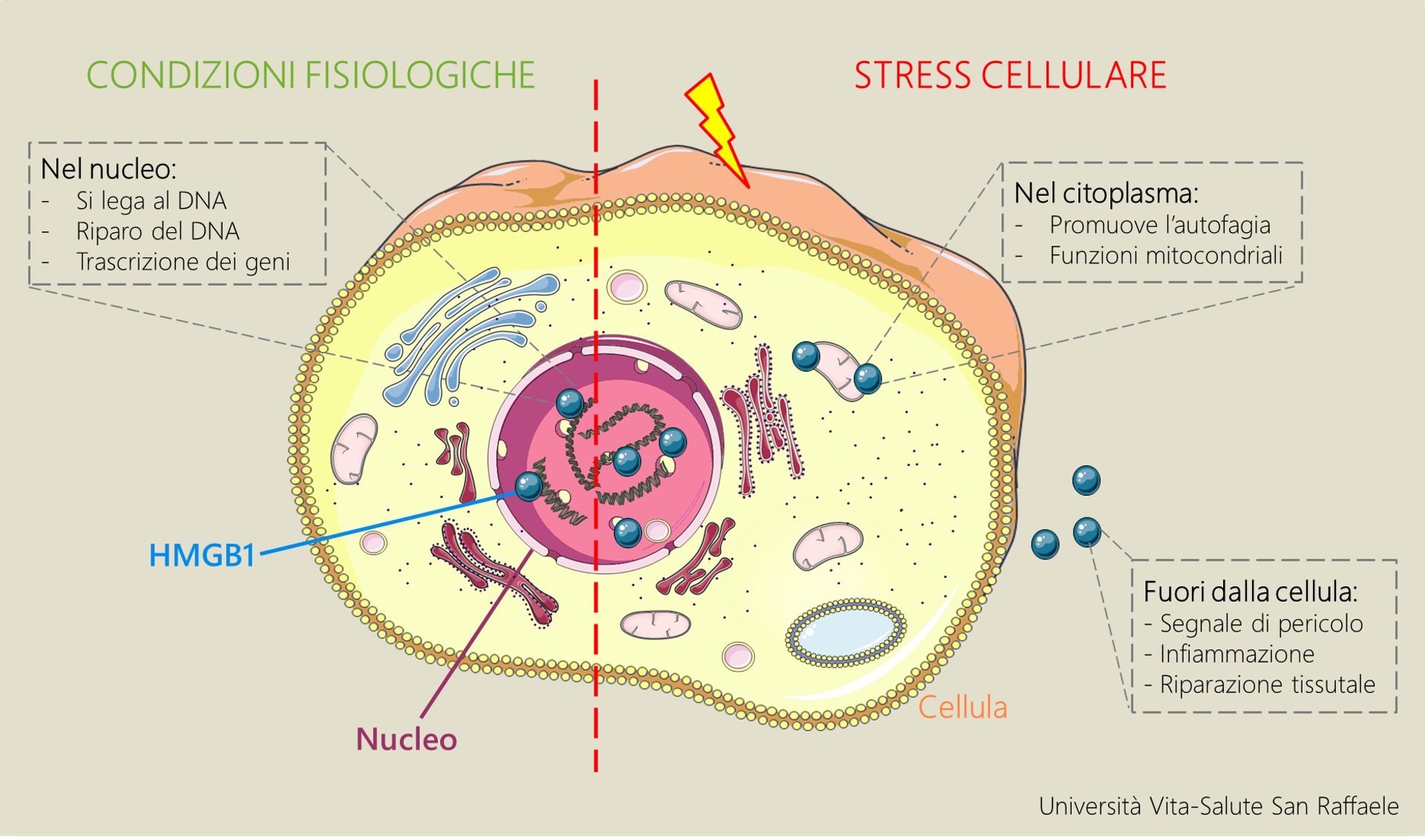
“La proteina HMGB1 (High Mobility Group 1) è conosciuta e studiata da molto tempo, ma la maggior parte delle ricerche si è sempre concentrata sul suo ruolo nell’infiammazione e su come bloccare la proteina per inibire il processo infiammatorio” spiega la Dott.ssa Vénéreau. “HMGB1 viene rilasciata ogni volta che si verifica uno stress o un danno in un tessuto: questo rilascio funziona come segnale di allarme che richiama le cellule del sistema immunitario nel sito danneggiato. La nostra idea è stata pensare che possa essere importante anche per il riparo tissutale, la fase successiva all’infiammazione in cui le cellule staminali ricostituiscono il tessuto”.
Già nel 2012 il gruppo coordinato dal Prof. Bianchi aveva dimostrato che le diverse attività extracellulari di HMGB1 dipendessero dal suo stato di ossidazione: quando la proteina è in forma ossidata, promuove l’infiammazione; viceversa la sua forma ridotta (non ossidata) funziona come segnale di richiamo per cellule coinvolte nella riparazione tissutale.
Per quale motivo una stessa proteina dovrebbe indurre un’infiammazione da una parte e la rigenerazione dall’altra? Risponde il Prof. Bianchi: “Al momento non lo sappiamo con certezza, ma pensiamo possa esserci una sensata utilità: quando ci si ferisce e si subisce un trauma, quasi certamente si verifica anche un’infezione, che è necessario debellare prima di proseguire a rigenerare il tessuto. Secondo il nostro modello la stessa proteina decide se sussiste un’infezione – e quindi non è il momento di ricostruire il tessuto – oppure se l’infezione è assente e si può procedere con la riparazione tissutale. È ancora un’ipotesi, ma ci sembra che sia ragionevole”.
UNA PICCOLA MODIFICA PER UN GRANDE RISULTATO
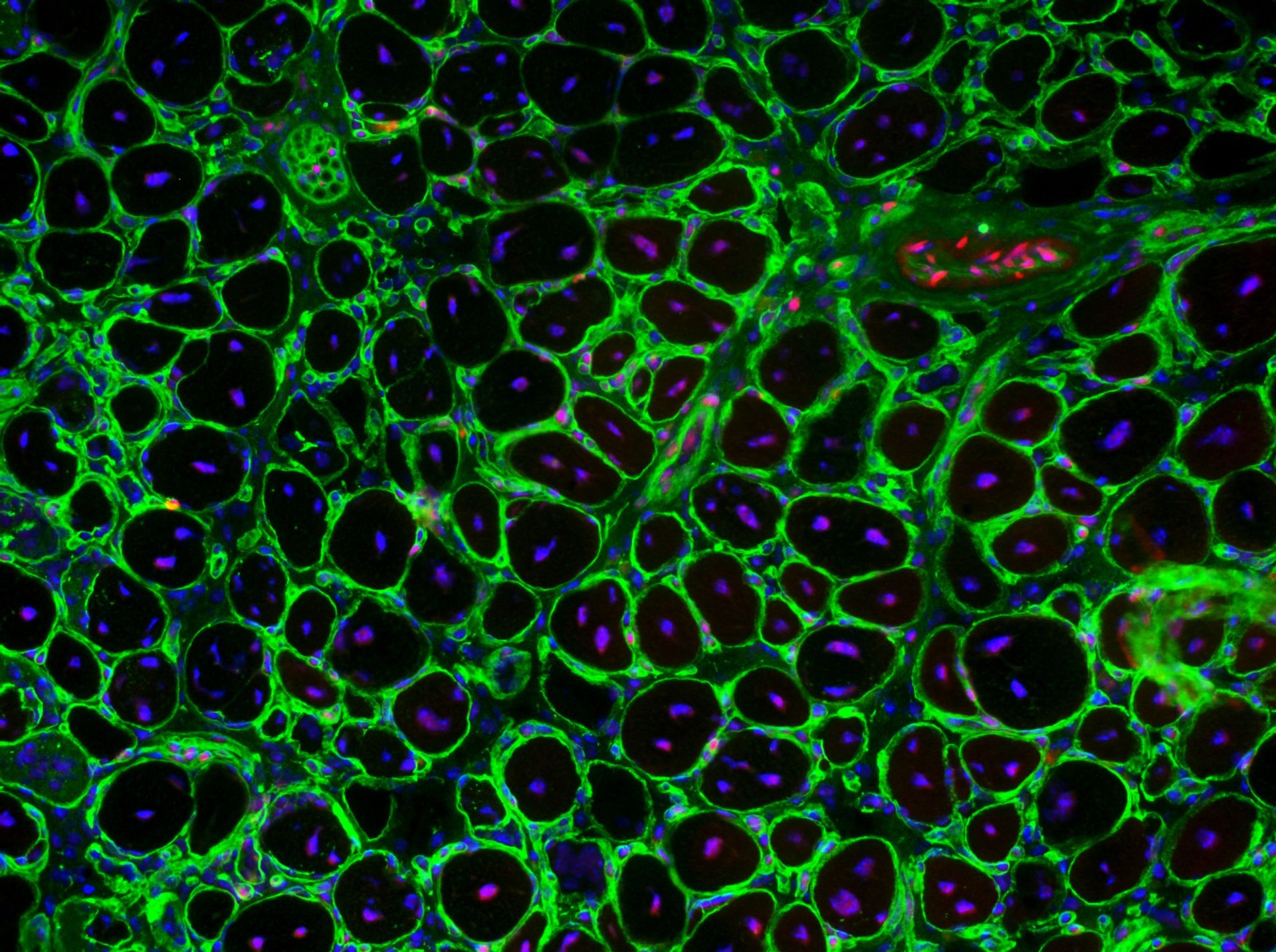
“In questo studio abbiamo creato una forma modificata della proteina, detta 3S-HMGB1”: la nuova proteina presenta infatti come amminoacidi (i “mattoncini” che compongono la proteina) 3 serine (S) al posto delle cisteine (C) normalmente presenti. “Questa nuova forma non è più ossidabile dalla cellula, e in questo modo consente di riparare i tessuti (l’abbiamo dimostrato in particolar modo nel muscolo e nel fegato dei topi) senza però indurre infiammazione”.
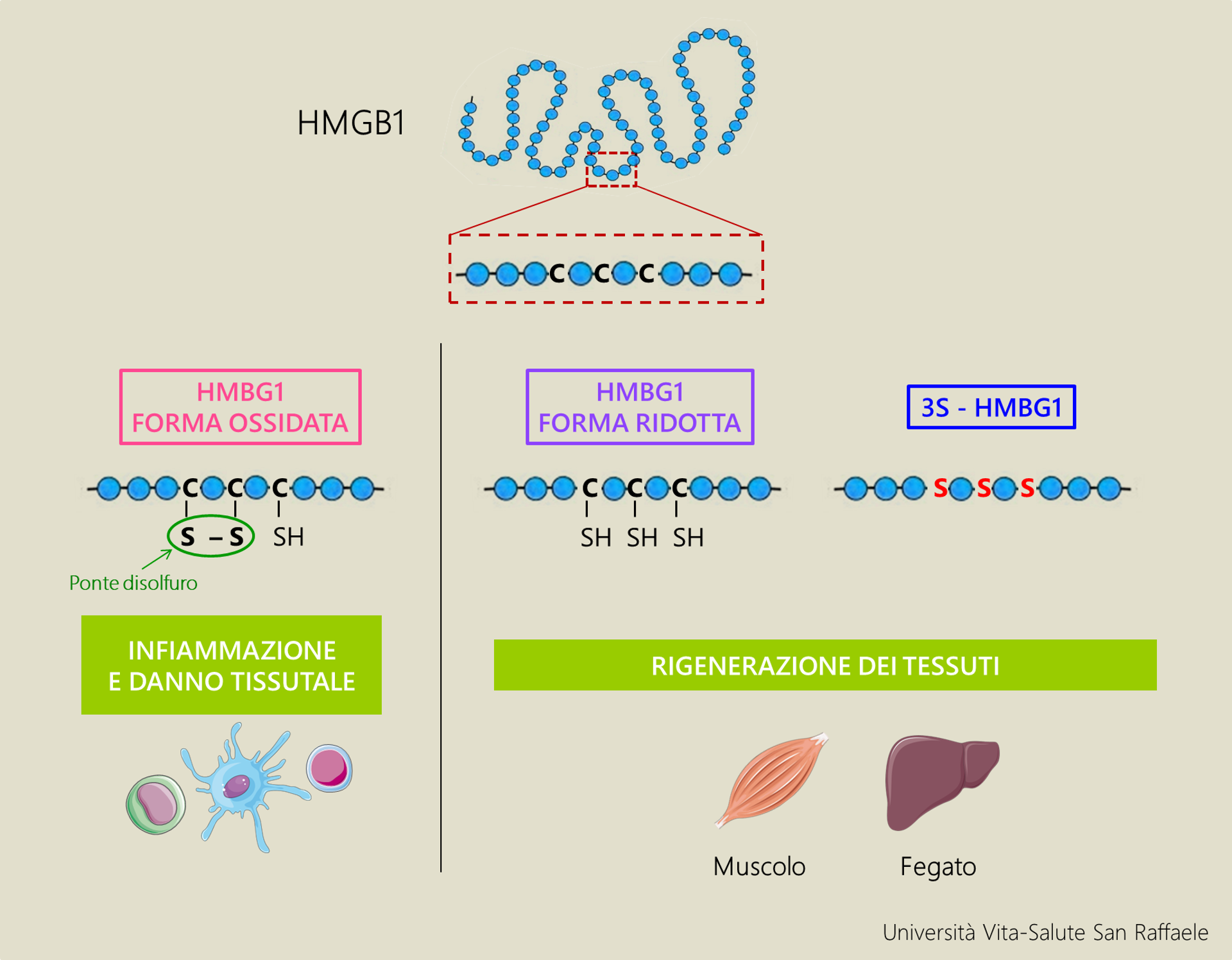
Continua la Dott.ssa Vénéreau: “Altre molecole descritte in letteratura si sono dimostrate efficaci nella rigenerazione tissutale, ma necessitavano di essere somministrate più volte a settimana (se non addirittura più volte al giorno). Il dato davvero incoraggiante emerso da nostro studio è che sia sufficiente una singola iniezione di 3S-HMGB1 per accelerare di due volte il riparo del muscolo e del fegato agendo, rispettivamente, sulle cellule staminali muscolari residenti o sugli epatociti (le cellule del fegato che svolgono la funzione rigenerativa in questo organo)”.
Osserva il Dott. Tirone, primo autore dello studio e dottorando di Silvia Brunelli, docente presso l’Università degli Studi di Milano-Bicocca e co-autrice del lavoro: “3S-HMGB1 risulta molto più stabile di HMGB1 naturale, tanto che i topi iniettati con questa forma modificata danno risposte molto simili ed omogenee. Forse è anche per questo che funziona meglio e che non c’è bisogno di ulteriori iniezioni”.

UNA SPERIMENTAZIONE (PER ORA) SOLO ANIMALE
“I risultati sono stati finora ottenuti sperimentando solo sui topi; per un’applicazione clinica sull’uomo ci vorrà ancora del tempo” precisa la Dott.ssa Vénéreau. Quali sono le difficoltà? “Innanzitutto dovremmo trovare la patologia giusta in cui testare l’efficacia di 3S-HMGB1, che non è una questione banale. Inizialmente la nostra scelta era ricaduta sulle patologie dell’osso. Il problema tuttavia è che per l’osso non ci sono standard di cura: le fratture ossee sono talmente comuni ed eterogenee che è difficile valutare in maniera oggettiva l’effettiva validità della nostra molecola. Un’altra difficoltà da non sottovalutare è la scarsità di fondi alla ricerca”.
“L’applicazione di 3S-HMGB1 sull’uomo – aggiunge il Dott. Tirone – darebbe indubbi vantaggi: basti pensare ad esempio alla degenza post-operatoria, che può essere ridotta grazie alla rigenerazione tissutale più rapida. Questo porterebbe a un’inferiore durata di ospedalizzazione e a una riduzione dei costi per le strutture ospedaliere e il Sistema Sanitario Nazionale”.
Ad oggi gli unici approcci terapeutici in fase di studio sono volti a neutralizzare del tutto l’attività della proteina HMGB1, in particolare a seguito di un trauma o in patologie infiammatorie, eliminandone in questo modo sia i suoi effetti pro-infiammatori che quelli rigenerativi. “Le nostre ricerche suggeriscono invece che inibire in maniera selettiva la sua ossidazione sarebbe un approccio terapeutico decisamente più promettente. Questo permetterebbe di limitare la presenza della forma ossidata, deleteria, favorendo al contrario la forma ridotta, rigenerativa. Anche se siamo lontani dall’uso del 3S-HMGB1 in pazienti, puntare sull’inibizione dell’ossidazione di HMGB1 potrebbe trovare applicazioni più immediate”.
La comprensione della duplice natura di HMGB1 potrebbe avere importanti implicazioni anche in campo oncologico, in cui al contrario è l’azione infiammatoria della proteina naturale ad avere un potenziale ruolo terapeutico. “I tumori si comportano in modo simile a tessuti danneggiati” aggiunge il Prof. Bianchi. “In questo caso l’azione rigenerativa di HMGB1 può essere però dannosa. Sfruttando le sue proprietà infiammatorie, si potrebbe invece ostacolare la crescita del tumore”.
Il Prof. Bianchi e la Dott.ssa Vénéreau hanno preso parte a un documentario italiano che parla di epigenetica, vincitore di un importante premio negli Stati Uniti: leggi di più cliccando qui!
You might be interested in

Multiple sclerosis, breakthrough in research: researchers have identified a molecule that promotes repair of the nervous system
The microbiome as an ally against myeloma

Intrecci: a UniSR project for more inclusive and accessible cancer diagnosis