Da virus dell'influenza pandemica a stagionale: identificate le 4 mutazioni responsabili
Nel 1918 l’epidemia nota come “Spagnola” causò, nel giro di 2 mesi, la morte di almeno 50 milioni di persone (3-5% della popolazione mondiale): un virus apparentemente innocuo fu la causa della pandemia più devastante della storia. A quella del 1918 seguirono altre tre pandemie: la “Asiatica” (1957), la “Hong Kong” (1968) e la più recente “Suina” (2009).
L’agente causale di queste pandemie appartiene alla famiglia dei virus dell’influenza A, lo stesso che evolve provocando la classica influenza stagionale (con sintomi generalmente lievi che regrediscono in ca. una settimana). Com’è possibile che due virus appartenenti alla stessa famiglia possano causare patologie così diverse?
A questa incognita si sono dedicati i ricercatori dell’Unità “Patogeni Virali e Biosicurezza” dell’IRCCS Ospedale San Raffaele. Ne è derivato un affascinante e innovativo lavoro che, a cent’anni esatti dalla prima pandemia, aggiunge un importante tassello alla soluzione del mistero di cui è ancora avvolta. A raccontarci la ricerca sono la Dott.ssa Isabel Pagani, prima firma della ricerca e studentessa del PhD in Molecular Medicine presso l’Università Vita-Salute San Raffaele, e la Dott.ssa Elisa Vicenzi, Capo dell’Unità.
LA STRUTTURA DEL VIRUS DELL’INFLUENZA DI TIPO A
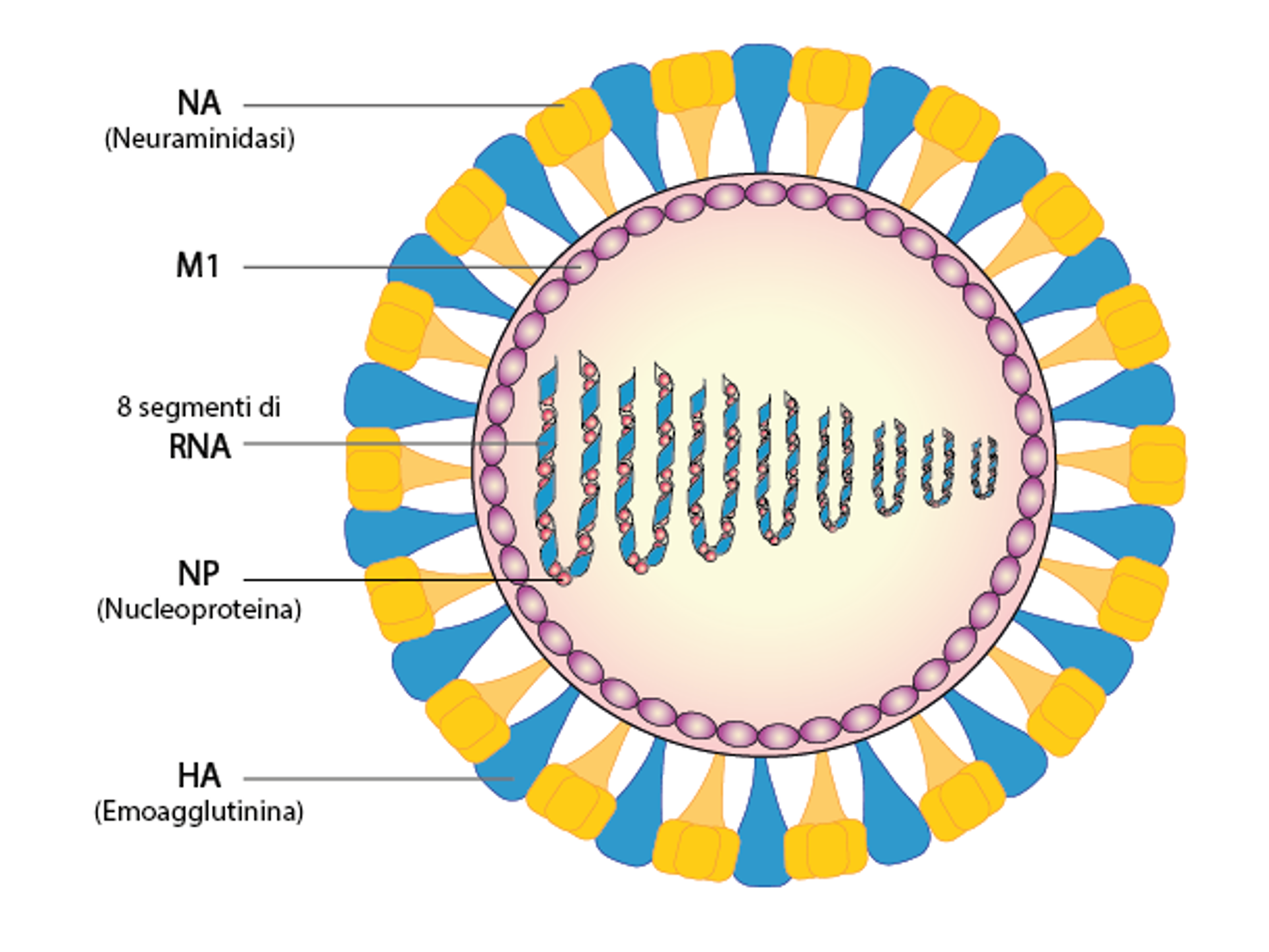
Il virus dell’influenza A ha una forma sferoidale ed è dotato di una membrana (che lo separa dall’ambiente esterno) derivata dalla cellula infettata. Ancorate nella membrana ci sono delle proteine, chiamate HA (dall’inglese Hemagglutinin, in italiano emoagglutinina) e NA (neuraminidasi). In natura, sono presenti 16 HA e 9 NA che possono combinarsi per generare sottotipi di virus influenzale (ad esempio H1N1, H2N2, H3N2 ecc). All’interno della particella si trova l’informazione genetica del virus, 8 segmenti di RNA; ciascuno di essi associato con altre proteine. Ai fini di questa ricerca è importante sottolineare l’importanza di queste proteine, ovvero la nucleoproteina (NP).
DA DOVE NASCE L’IDEA DI QUESTA RICERCA
Racconta la Dott.ssa Pagani: “Questa ricerca prende ispirazione da uno studio precedente: il Dott. Andrea Di Pietro, anch’egli studente di questo PhD presso la nostra Unità, ha pubblicato un articolo scientifico in cui si dimostrava come una proteina intracellulare indotta dall’Interferone, la proteina TRIM22, fosse in grado di inibire la replicazione del virus influenzale stagionale.
Quando un virus entra nelle cellule, esso stimola la sintesi di Interferone il quale promuove l’attivazione di decine di geni di risposta anti-virale tra cui, appunto, TRIM22; questa proteina interagisce direttamente con la nucleoproteina virale e le “attacca” tante molecole di ubiquitina. L’ubiquitina è una specie di “etichetta” che segnala al proteasoma (il macchinario di degradazione intracellulare) che la nucleoproteina è da eliminare: TRIM22 quindi induce la degradazione di una componente del virus indispensabile per la sua replicazione”.
Il virus dell’influenza è un virus zoonotico, cioè può essere trasmesso dall’animale all’uomo. “Nell’ospite animale, virus influenzali di diverso tipo possono combinarsi per dare origine a un nuovo virus: se questo arriva all’uomo, causa una pandemia, perché il sistema immunitario non è in grado di riconoscerlo”.
TRIM22 NON È IN GRADO DI CONTENERE L’INFEZIONE DEL VIRUS PANDEMICO
“La nostra domanda è stata quindi verificare se lo stesso meccanismo antivirale basato sull’induzione di TRIM22 potesse contenere l’infezione anche del virus influenzale pandemico”.
Per approfondire questo studio, le ricercatrici del San Raffaele hanno collaborato con la Dott.ssa Nadia Naffakh dell’Istituto Pasteur di Parigi, che ha fornito un campione di virus dell’influenza suina del 2009 per effettuare i test. “Abbiamo infettato alcune cellule con questo virus, e siamo andati a valutare la risposta di TRIM22: abbiamo scoperto che TRIM22 non è capace di contenere l’infezione del virus pandemico”.
Come mai? “Sappiamo che l’ubiquitinazione – che poi causa la degradazione della nucleoproteina nel proteasoma – avviene su un amminoacido in particolare, detto lisina (indicato con la lettera K). Facendo un confronto tra il virus influenzale stagionale e il virus pandemico abbiamo trovato un importante cambiamento: nei virus pandemici, 4 lisine vengono sostituite da 4 arginine, un altro amminoacido (indicato con la lettera R)”. Questo significa che:
- Nel virus influenzale stagionale, la nucleoproteina possiede 4 lisine, su cui TRIM22 fa avvenire la reazione di ubiquitinazione. In questo modo il proteasoma degrada la nucleoproteina del virus e viene abbassata la replicazione del virus.
- Nel virus pandemico, la nucleoproteina possiede 4 arginine: TRIM22 non trova più i residui su cui far avvenire l’ubiquitinazione. In questo modo la nucleoproteina del virus non viene degradata e il virus può procedere nella sua replicazione infettando nuove cellule.
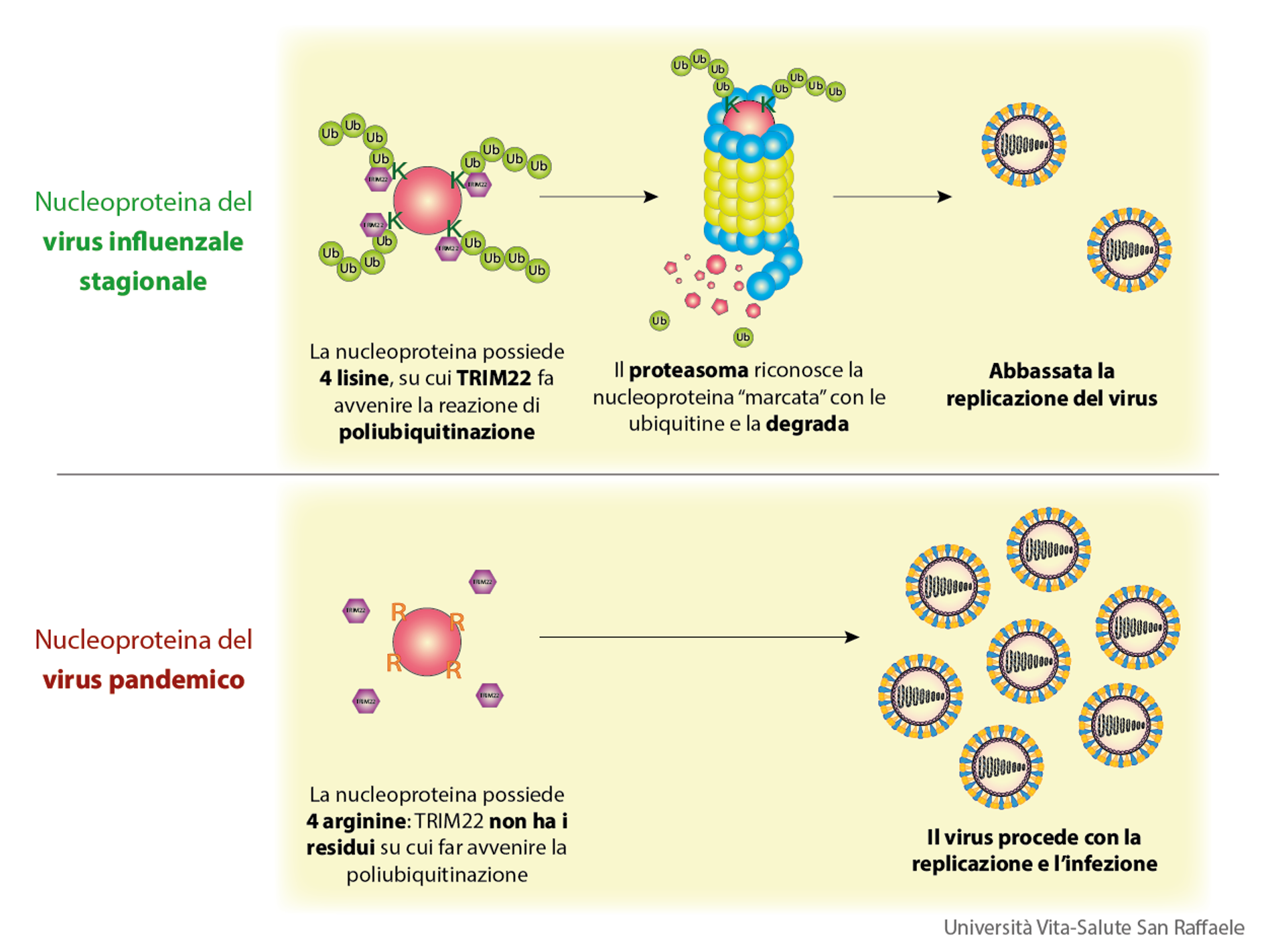
“Grazie alla complessa tecnica definita “reverse genetics”, abbiamo creato delle nucleoproteine con diversi mutanti” specifica la Dott.ssa Pagani “e abbiamo osservato che solo il “mutante quadruplo”, cioè il virus con tutte e 4 le lisine mutate in arginine, non era più suscettibile all’inibizione indotta da TRIM22”.

L’IMPORTANZA DI QUESTO STUDIO
Interviene la Dott.ssa Vicenzi: “Nel corso dell’ultimo secolo, il virus si è evoluto, passando per vari stati intermedi, da pandemico fino a stagionale. Per spiegare l’evoluzione virale, in un articolo pubblicato su Nature nel 1970, il genetista John Maynard Smith fece una curiosa analogia con un gioco della Settimana Enigmistica”. Partendo da una parola (= una proteina virale), si effettua un cambiamento (= una mutazione) di una lettera (= un amminoacido) per volta, facendo attenzione che tutti gli intermedi abbiano un significato (=che tutti i virus fossero in grado di replicarsi), per ottenere infine una parola (= una proteina) completamente diversa. Nell’esempio, in 4 passaggi si arriva da “CASO” a “ROMA”.
“La nostra ricerca ha dimostrato un meccanismo molto simile: dalle 4 arginine presenti nel virus pandemico, resistente all’azione di TRIM22, il virus si è evoluto cambiando un amminoacido per volta, fino ad avere le 4 lisine del virus influenzale stagionale, suscettibile all’azione di TRIM22”.
“L’Unità che dirigo si occupa anche di studiare la reazione del nostro sistema immunitario all’infezione virale” conclude la Dott.ssa Vicenzi. “Due sono le risposte possibili al virus influenzale: la produzione di anticorpi, indotta prevalentemente dall’emoagglutinina in grado di neutralizzare il virus prima che infetti le cellule e una mediata dai linfociti T citotossici, che riconoscono e uccidono le cellule infettate. Delle due, la risposta anticorpale è sempre stata la più studiata poiché su di essa è basata la vaccinazione stagionale. Invece, la risposta dei linfociti T citotossici è meno studiata, anche in chiave vaccinale. Il nostro lavoro suggerisce che l’evoluzione del virus da pandemico a stagionale sia stata fortemente influenzata da una collaborazione tra diverse componenti della risposta immunitaria ai virus quali appunto la risposta citotossica dei linfociti T e TRIM22, la molecola indotta dall’Interferone. Le implicazioni generali del nostro studio rientrano nello sforzo globale di giungere ad un “vaccino universale” protettivo contro tutti i virus dell’Influenza, sia stagionali che pandemici”.
You might be interested in

Multiple sclerosis, breakthrough in research: researchers have identified a molecule that promotes repair of the nervous system
The microbiome as an ally against myeloma

Intrecci: a UniSR project for more inclusive and accessible cancer diagnosis