Dottorando e dottorato UniSR UniSR primi autori su "Cell": l'epigenetica come "interruttore" per spegnere i geni

“Non serve per forza andare all’estero: anche da noi, con buone idee e perseveranza, si arriva molto lontano”
Conosciamo Angelo e Alessandro e scopriamo cos’hanno combinato
Angelo Amabile e Alessandro Migliara sono due ragazzi che amano il proprio lavoro, ci si dedicano con passione, impegno e tanto sacrificio. Angelo e Alessandro sono due giovani ricercatori, neo-dottorato il primo, dottorando l’altro, entrambi ex studenti modello della Magistrale in Biotecnologie dell’Università Vita-Salute San Raffaele. Ma il motivo per cui oggi parliamo di loro è perché sono “primi autori” di un sorprendente studio che è stato pubblicato sulla prestigiosa rivista scientifica “Cell”.
Essere primo autore in un articolo scientifico è importante: infatti, il primo autore, insieme all’ultimo, è il ricercatore che ha contribuito maggiormente allo studio, non solo da un punto di vista pratico ma anche nel suo disegno sperimentale.

Ma ora veniamo a noi: di cosa parla la ricerca pubblicata?
La novità del loro studio consiste nell’aver sviluppato una tecnologia che permette di spegnere in modo stabile l’espressione genica. Questo avviene grazie all’utilizzo di un “cocktail” di proteine (create appositamente in laboratorio) che legano in maniera specifica solo il gene per cui sono state costruite, spegnendone l’espressione. Inoltre, nonostante le cellule trattate siano esposte solo per un breve periodo di tempo a queste proteine, si instaura sul gene una vera e propria “memoria”, che permette di tramandare il silenziamento genico alle cellule figlie. L’applicazione di questa tecnologia permette di silenziare geni che, quando mutati, causano gravi malattie.
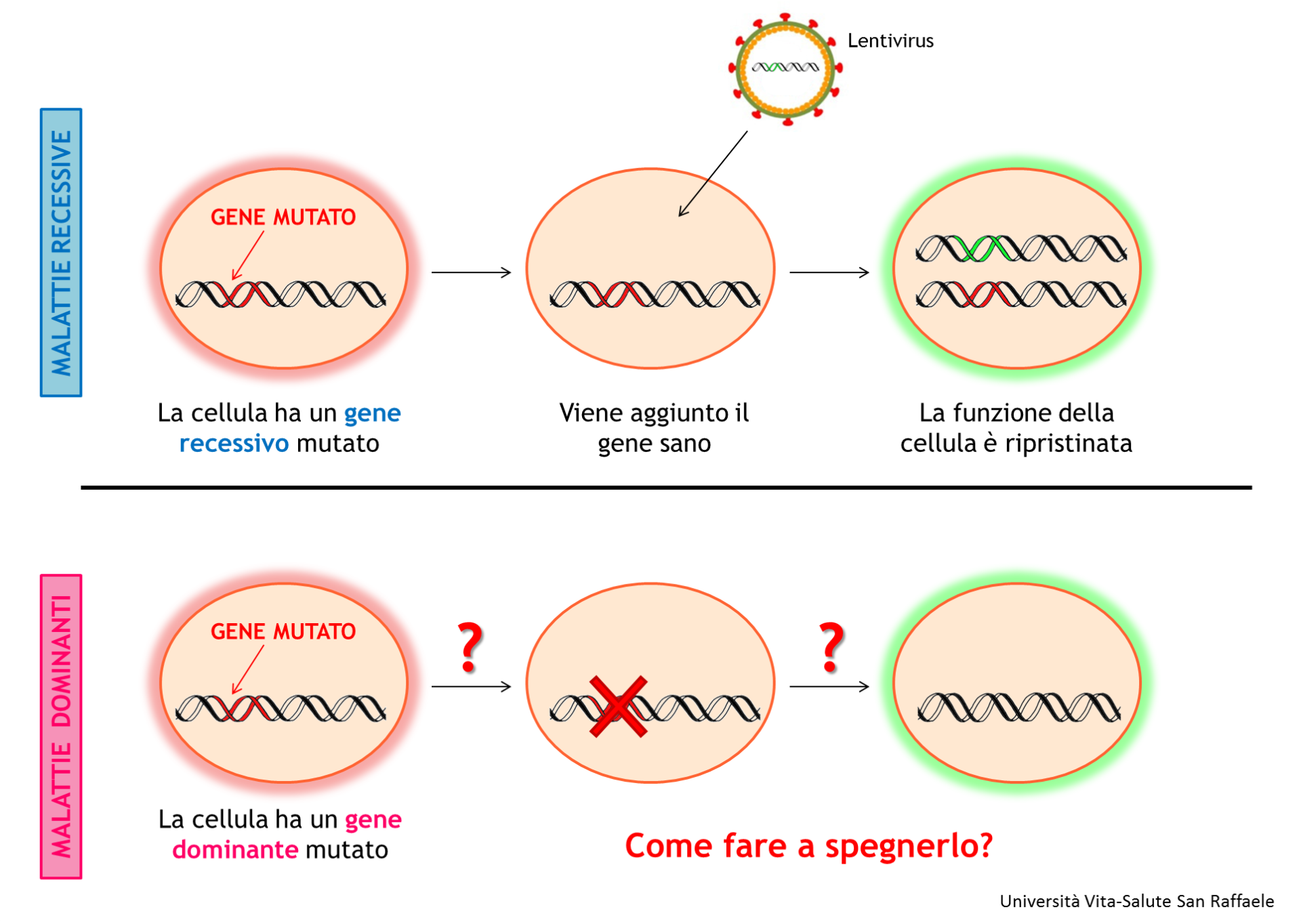
“Quando una malattia è recessiva, cioè le cellule del paziente possiedano entrambe le copie di un gene mutate, si può aggiungere una copia funzionante dello stesso tramite l’utilizzo di vettori virali derivati da virus (qui all’Istituto San Raffaele Telethon per la Terapia Genica [SR-Tiget] utilizziamo i lentivirus). Questa procedura permette di ripristinare la normale funzione del gene nella cellula” ci spiega Angelo. “Il problema nasce quando dobbiamo trattare delle malattie causate da mutazioni che fanno acquisire al gene una nuova funzione, che ostacola l’attività dell’altra copia funzionante del gene, come malattie dominanti a effetto negativo. In questo caso, per trattare la malattia dobbiamo spegnere o inattivare il gene mal funzionante”.
Ad oggi, le tecniche utilizzate per inattivare un gene dannoso si basano su veri e propri bisturi molecolari. Queste molecole tagliano il DNA a livello del gene bersaglio, distruggendone il codice genetico e inattivandone quindi la funzione. Nonostante questa tecnica dia risultati incoraggianti, il rischio di inattivare altri geni all’infuori del gene dannoso per la cellula o di indurre alterazioni del genoma limitano l’applicabilità terapeutica di questa procedura.
Angelo e Alessandro, che lavorano nel gruppo di Regolazione epigenetica e modificazione mirata del genoma diretto da Angelo Lombardo, ricercatore dell’UniSR e Group Leader del SR-Tiget, in collaborazione con il gruppo del Professor Luigi Naldini, Ordinario di Terapia Genica e Cellulare e di Istologia presso UniSR e direttore del SR-Tiget, hanno messo a punto una strategia alternativa: piuttosto che inattivare il gene malattia alterando il codice genetico, hanno pensato di agire sul suo “codice epigenetico”.
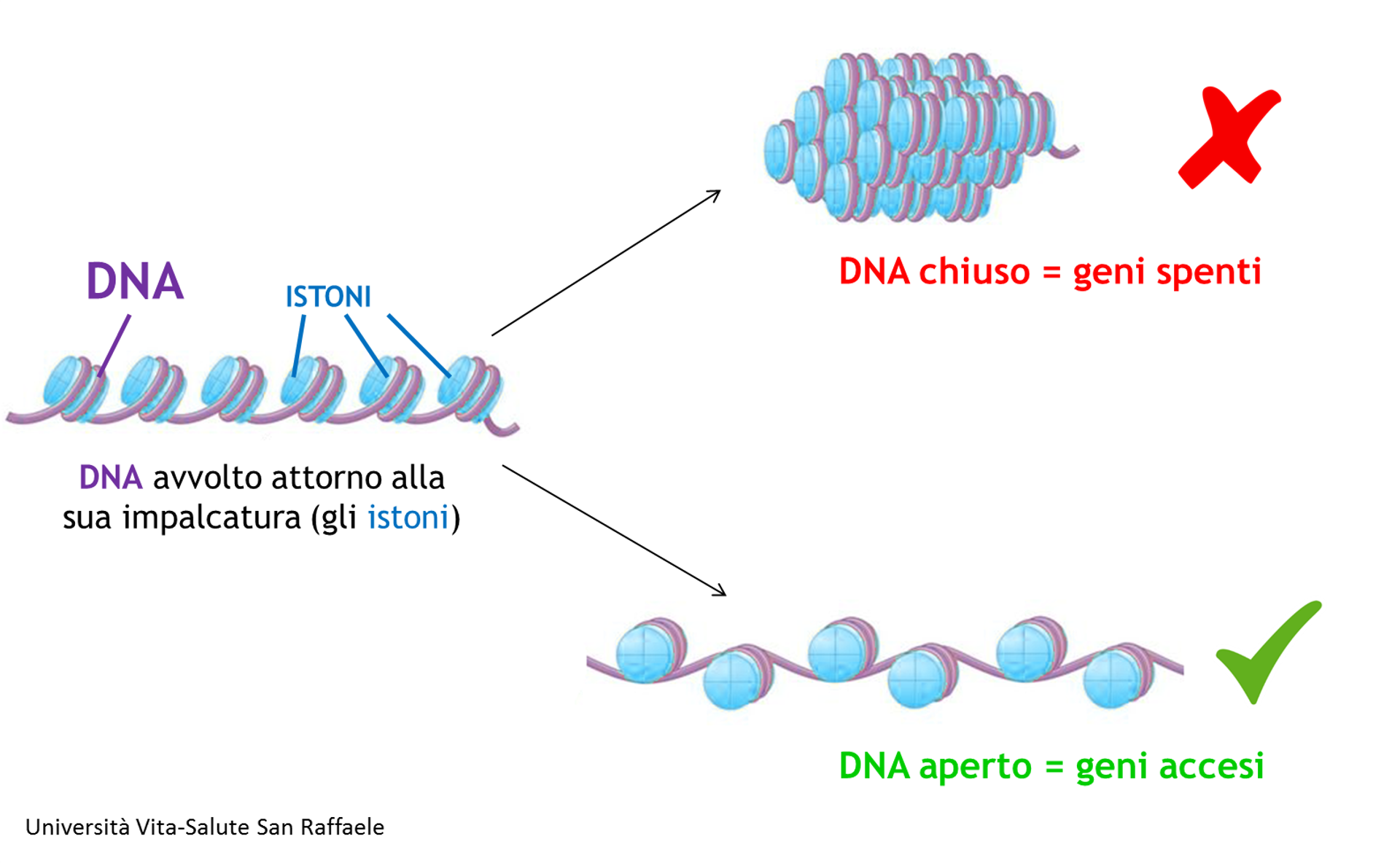
“Epigenetica” significa “che sta al di sopra del gene”: modificare l’epigenetica significa andare a toccare non l’informazione contenuta nei geni, bensì i meccanismi con cui la cellula legge queste informazioni. È come se il DNA fosse un libro con milioni di pagine che contengono delle informazioni; modificare il codice genetico è come strappare la pagina di un libro; modificare il codice epigenetico invece è come coprire con un colore indelebile le righe di un testo perché non si leggano più. L’effetto che si ottiene è lo stesso, cioè che quell’informazione non è più leggibile; un potenziale vantaggio dell’agire sull’epigenetica è che si ha un effetto più sicuro.
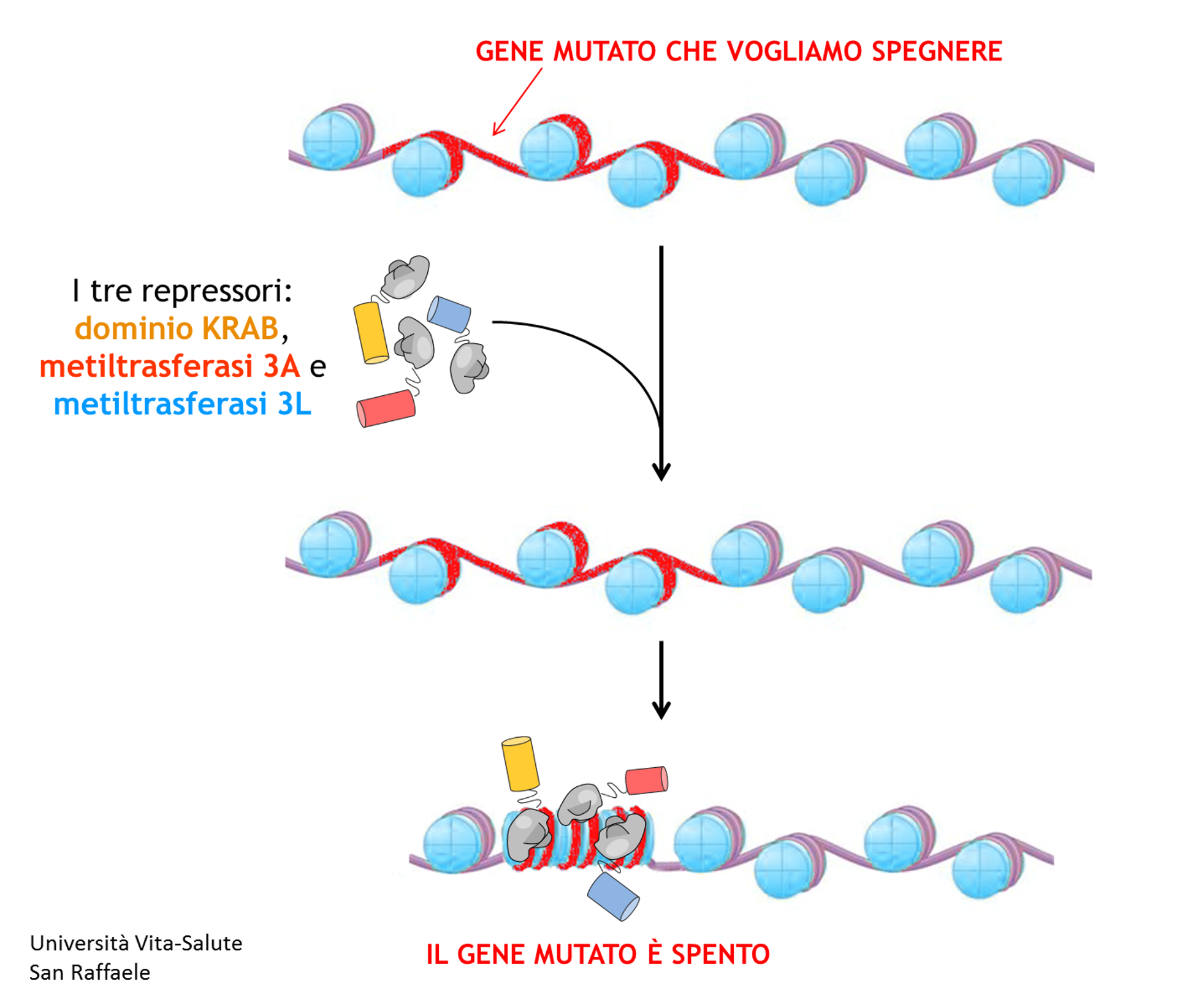
“La sfida” prosegue Angelo “è stata di identificare la combinazione giusta di proteine che, una volta entrate all’interno della cellula, sono in grado di legarsi solamente al gene che vogliamo spegnere e indurre in quel punto un silenziamento stabile del gene”. Dopo tanto studio, Angelo e Alessandro sono stati in grado di scoprire un “cocktail perfetto” di 3 repressori: “Queste tre proteine si trovano contemporaneamente espresse solo nell’embrione, e dettano quali geni spegnere e quali lasciare accesi per il resto della vita dell’individuo”.
Precisa Alessandro: “I tre fattori da noi utilizzati sono: il dominio KRAB, la metiltrasferasi 3A e il suo cofattore, la metiltrasferasi 3L. Se espressi individualmente, questi fattori non inducono un silenziamento permanente del loro gene bersaglio (osservazione in linea con quanto già riportato in letteratura da altri ricercatori). Al contrario, abbiamo scoperto che quando combinati, i tre fattori creano un complesso repressivo molto potente, in grado di spegnere stabilmente i nostri geni bersaglio. Al centro di questo sistema si trova la proteina embrionale metiltrasferasi 3L, la chiave che attiva il motore di questo complesso repressivo”.
Come funzionano queste tre molecole combinate?
Una volta che queste tre proteine si legano contemporaneamente al gene bersaglio, reclutano una serie di altri fattori che inducono la chiusura dell’elica di DNA , rendendolo inaccessibile al macchinario che legge quel gene. Ecco perché si dice che questo gene risulta spento.
Alessandro spiega: “Abbiamo modificato i tre fattori in modo tale che legassero selettivamente il gene che volevamo spegnere; li abbiamo poi inseriti nelle cellule e siamo andati a guardare se il nostro gene di interesse fosse spento o meno. I risultati sono stati sorprendenti:
- nonostante i repressori siano presenti per soli pochi giorni nella cellula, il gene si spegne permanentemente (abbiamo seguito le cellule fino ad un anno dal trattamento), indicando che il silenziamento che introduciamo viene tramandato anche alle cellule figlie durante la divisione cellulare;
- la tecnologia funziona in diversi tipi cellulari, tra cui i linfociti T, cellule importanti nell’ambito della terapia del tumore;
- i nostri repressori artificiali sono in grado di spegnere contemporaneamente più geni nella stessa cellula ;
- l’effetto di spegnimento risulta specifico e limitato al gene di interesse, senza alterare in modo significativo l’espressione degli altri geni. Questo potrebbe essere un grande vantaggio rispetto alle tecnologie che si basano sull’utilizzo di bisturi molecolari, che provocano anche alterazioni aspecifiche nel genoma, e quindi potenzialmente pericolose per la cellula”.


Quali sono le applicazioni future?
Le applicazioni terapeutiche di questa nuova tecnologia di silenziamento genico sono diverse: oltre all’inattivazione di geni con effetto dominate negativo, si potrebbero spegnere anche i geni coinvolti nella regolazione della risposta immunitaria, per rendere i globuli bianchi più aggressivi contro le cellule tumorali o invisibili al sistema immunitario del paziente al quale vengono trapiantati, che altrimenti li attacca causando il rigetto. L’uso del silenziamento genico nell’immunoterapia dei tumori è già in corso di sperimentazione sull’uomo usando però bisturi molecolari, e potrebbe ricevere un’ulteriore spinta dalla disponibilità di questa nuova tecnica epigenetica, verosimilmente meglio tollerata e più sicura.
“Il nostro studio è la prova che se si ha un’idea molto buona, si è disposti a lavorare duro, con costanza e perseveranza, e l’Istituto in cui si lavora è un centro di eccellenza, non necessariamente bisogna fare ricerca all’estero, perché i risultati vengano riconosciuti a livello internazionale” concludono insieme. A ulteriore riprova della rilevanza di questo studio, il lavoro di Angelo e Alessandro è stato premiato quest’anno a Washington con l’Excellence Research Award dalla Società Americana di Terapia Genica e Cellulare (ASGCT).
A loro, e a tutti i giovani che si dedicano alla ricerca con impegno e passione per mettersi al servizio dei pazienti, facciamo un grande in bocca al lupo!
Ti potrebbero anche interessare

Sclerosi multipla, svolta nella ricerca: individuata una molecola che promuove la riparazione del sistema nervoso

Università Vita-Salute San Raffaele al top in Italia
Il microbioma come alleato contro il mieloma

