Amiloidosi: una ricerca UniSR scopre il tallone d'Achille delle plasmacellule killer
Avete mai sentito parlare di amiloidosi? No? Non vi preoccupate, non c’è da stupirsi; in effetti è una malattia molto rara, e finora pochi laboratori al mondo si sono occupati di studiarla nel dettaglio.
La ricerca che raccontiamo oggi, però, è sorprendente per diverse ragioni: non solo ha permesso di approfondire le conoscenze del mondo scientifico su questa malattia quasi sconosciuta, ma apre le porte a delle strategie terapeutiche efficaci per poterla trattare. Curiosi? Procediamo con ordine.
CHE COS’È L’AMILOIDOSI?
L’amiloidosi è una malattia causata dall’accumulo di una proteina anormale. Nel nostro midollo osseo ci sono delle cellule, dette plasmacellule, che producono gli anticorpi (che ci difendono contro le infezioni e i microbi esterni); con il passare degli anni si può accumulare un clone, cioè un insieme di plasmacellule che producono e secernono tutte lo stesso anticorpo.
In condizioni molto sfortunate però, a causa di mutazioni genetiche, un piccolo gruppo di plasmacellule produce una proteina anormale – la catena leggera – che può aggregarsi e depositarsi in diversi organi (principalmente il cuore).
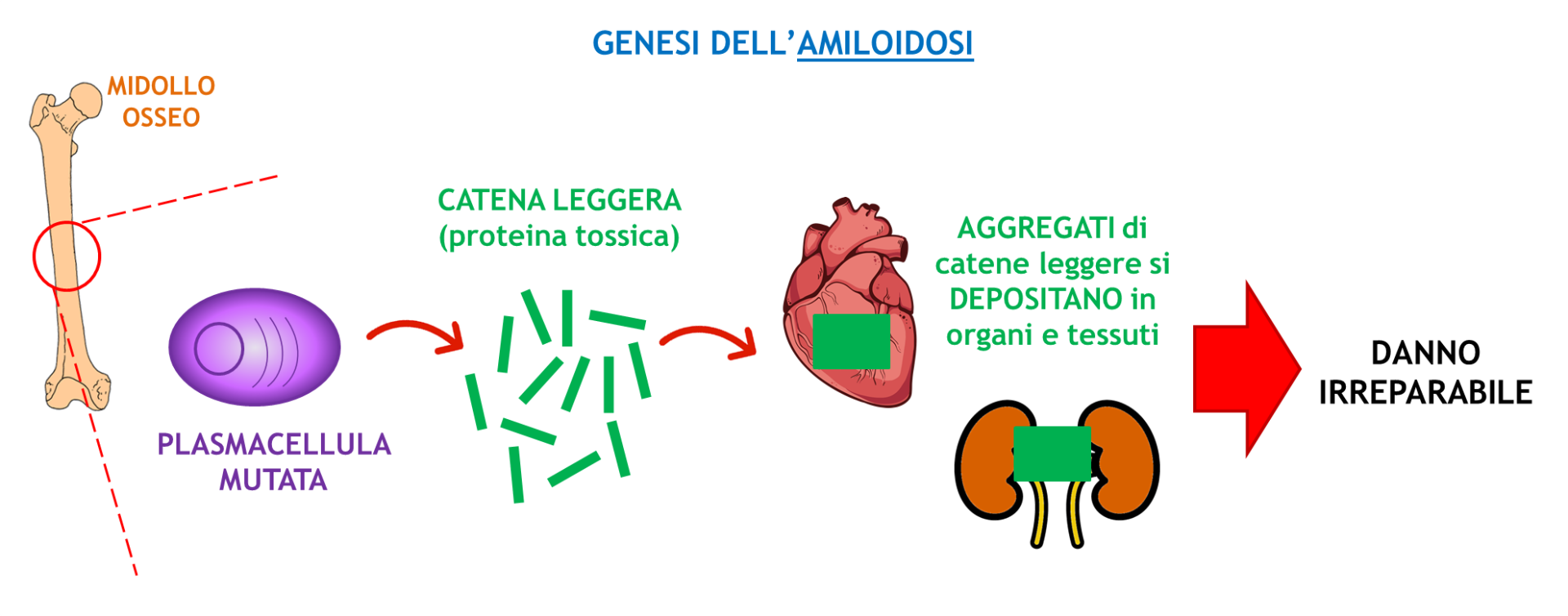
AMILOIDOSI DA CATENE LEGGERE, OVVERO CELLULE ALTAMENTE STRESSATE
Finora i ricercatori si erano prevalentemente concentrati a studiare strategie per proteggere gli organi che vengono bersagliati dall’accumulo delle catene leggere, provando per esempio a intervenire chimicamente per “sciogliere” i depositi dannosi.
Il Dott. Simone Cenci, Capo dell’Unità “Malattie dell’Invecchiamento” e coordinatore di questo progetto, ci racconta: “Abbiamo intuito che forse queste plasmacellule possiedono una qualche fragilità dovuta alla produzione della tossina fatale”.
La Dott.ssa Laura Oliva, brillante postdoc presso l’Unità del Dott. Cenci, è prima autrice dello studio, condotto in collaborazione con il Policlinico San Matteo di Pavia, centro europeo di riferimento per i pazienti affetti da amiloidosi.
I ricercatori hanno purificato le plasmacellule dal midollo dei pazienti con amiloidosi e sono andati a studiare da vicino queste cellule. “Non abbiamo usato delle tecniche particolarmente innovative o complesse per effettuare questo studio” spiega il Dott. Cenci; “la vera innovazione è stata l’idea, un po’ fuori dagli schemi, che queste cellule avessero una fragilità intrinseca, e le nostre intuizioni hanno trovato conferma”.
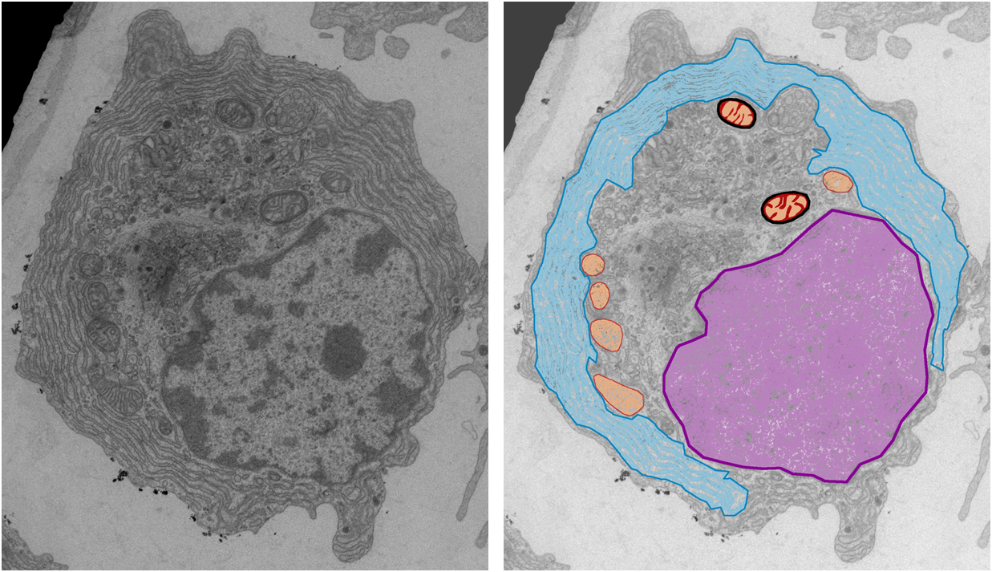
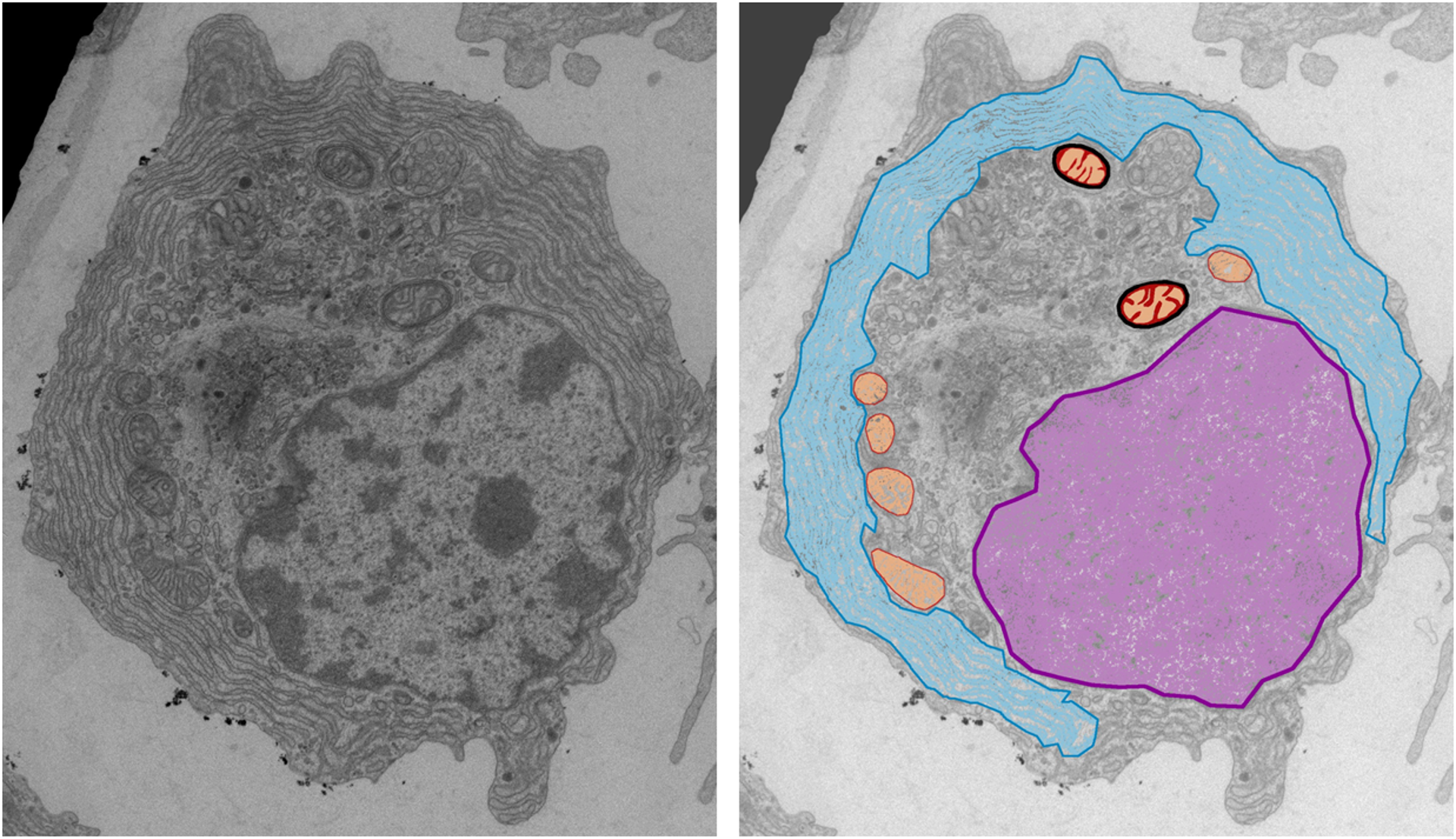
I ricercatori hanno fotografato (in senso letterale) per la prima volta queste plasmacellule, per scoprire che in effetti hanno un aspetto particolare: hanno distretti cellulari stressati.
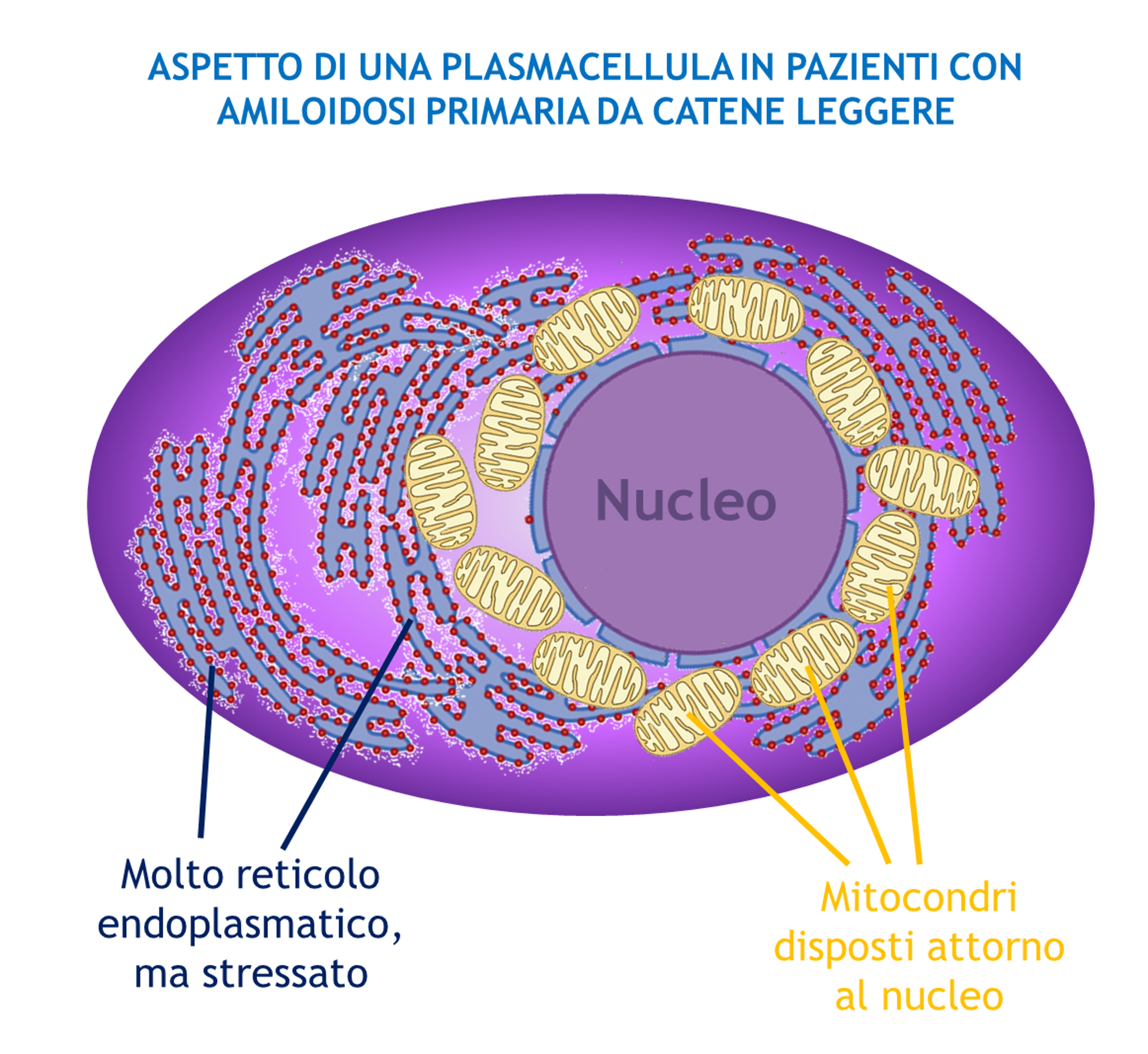
Queste cellule hanno più reticolo endoplasmatico, la fabbrica delle catene leggere responsabili della malattia. Questo reticolo, però, mostra segni di stress rispetto a quello delle plasmacellule che producono catene normali. Inoltre, i mitocondri appaiono normali, ma sono localizzati attorno al nucleo, un dato che sta emergendo sempre più come indicatore di uno stress ossidativo in atto nella cellula.
Uno dei meriti di questo studio è stato quindi quello di aver caratterizzato da un punto di vista morfologico, funzionale e molecolare queste cellule per scoprire che erano stressate, quindi fragili.
VA BENE, CELLULE FRAGILI…E QUINDI?
Per capire l’importanza di questo studio bisogna fare una piccola premessa. Le cellule del nostro organismo si mantengono funzionanti non solo producendo le proteine di cui hanno bisogno, ma anche smontando e riciclando quelle che non sono più necessarie. Fino a qualche anno fa si pensava che il principale responsabile di quest’attività di riciclo fosse il proteasoma, un organello con il compito di degradare le proteine sulle quali la cellula ha posto un’“etichetta” speciale (detta ubiquitina). Oggi invece si sa che esiste un’altra strategia cellulare di riciclaggio delle proteine: l’autofagia, un processo più drastico attraverso il quale una vescicola di membrana ingloba e degrada pacchetti di proteine o interi organelli cellulari (tra l’altro, la scoperta dell’autofagia ha vinto il Nobel per la Medicina 2016. Ce ne ha parlato proprio il Dott. Cenci in questa bella intervista: https://goo.gl/Mhlxss).
“Mentre stavamo valutando il ruolo della catena leggera nello stress cellulare, abbiamo letto i primi studi clinici che mostravano che i pazienti affetti da amiloidosi rispondevano inaspettatamente bene al Bortezomib, un farmaco che inibisce il proteasoma”. Generalmente questo farmaco viene somministrato ai pazienti affetti da mieloma multiplo, un tumore del midollo osseo: inibendo il proteasoma, il sistema di smaltimento dei rifiuti cellulari si trova sotto stress, le cellule malate non riescono più a far fronte a questa situazione e così muoiono.
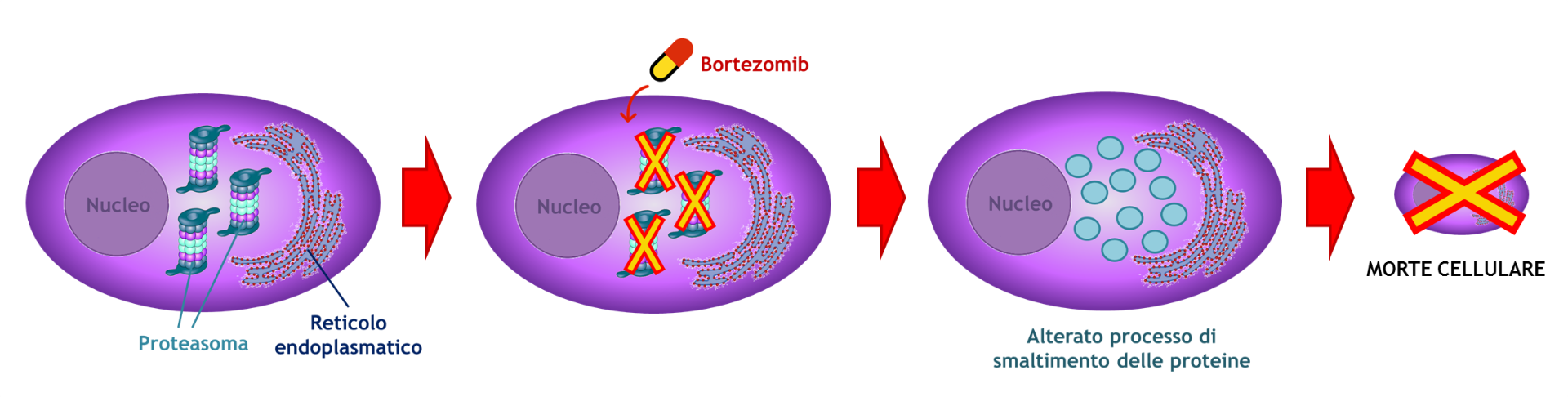
“Non avendo cure specifiche, i pazienti con amiloidosi sono stati ugualmente trattati con Bortezomib, ma con sorpresa si è notato che rispondevano clinicamente persino meglio di quelli con mieloma. La nostra ricerca ha provato che la produzione di catena leggera causa stress non tanto a carico del proteasoma, bensì dell’autofagia, meccanismo da cui le plasmacellule sono estremamente dipendenti, come da noi recentemente scoperto”.
Questo risultato può spiegare la risposta clinica al Bortezomib e indica nuove strade per la messa a punto di strategie efficaci quali l’inibizione dell’autofagia, che determinerebbe la morte delle cellule malate.
IL PRIMO MODELLO CELLULARE DELLA MALATTIA
Infine, un’altra informazione importante: per ottenere questi risultati i ricercatori del San Raffaele hanno creato in laboratorio il primo modello cellulare di amiloidosi da catene leggere. “Abbiamo inserito la catena leggera dei pazienti con amiloidosi in plasmacellule vuote e indotto l’espressione della catena leggera: poi abbiamo misurato i suoi effetti sullo stress cellulare e sulla sensibilità ai farmaci”. Il modello ha dimostrato formalmente per la prima volta che esprimendo la catena leggera amiloidogenica, questa sovraccarica specificatamente l’autofagia, causando stress ossidativo e generando una maggiore sensibilità agli inibitori del proteasoma. Una notizia straordinaria, perché “questo modello sarà ora a disposizione di tutti i laboratori del mondo, e renderà lo studio dell’amiloidosi, una malattia rara, più diffuso ed accessibile”.
Ti potrebbero anche interessare

Sclerosi multipla, svolta nella ricerca: individuata una molecola che promuove la riparazione del sistema nervoso

Università Vita-Salute San Raffaele al top in Italia
Il microbioma come alleato contro il mieloma

