Al San Raffaele scoperto l’interruttore che attiva la formazione dei muscoli
Durante lo sviluppo embrionale – o nel corso della vita adulta, quando occorre riparare un danno ai muscoli – le cellule staminali muscolari si moltiplicano, si fondono tra loro e differenziano per formare le fibre necessarie a rigenerare il tessuto. Uno studio pubblicato su Nature Communications riporta la scoperta del primo interruttore molecolare che regola questo processo, il cui malfunzionamento è coinvolto in molte malattie, tra cui la distrofia muscolare di Duchenne (DMD). La ricerca è firmata dal gruppo del Dott. Davide Gabellini, capo dell’Unità “Espressione genica e distrofia muscolare” dell’IRCCS Ospedale San Raffaele di Milano, e apre la strada alla messa a punto di nuove strategie terapeutiche che agiscano proprio su questo interruttore per facilitare il processo rigenerativo.
LA FUSIONE DELLE CELLULE MUSCOLARI
Spiega il Dott. Gabellini: “Una caratteristica distintiva della muscolatura scheletrica è di essere uno dei pochi tessuti del corpo dove il costituente di base non è la singola cellula, bensì un sincizio originato dalla fusione di centinaia di cellule che formano la fibra muscolare. Questo processo di fusione è assolutamente fondamentale per consentire l’originarsi dei muscoli”. Durante lo sviluppo embrionale o a seguito di una lesione – come quelle prodotte da un intenso sforzo fisico – le cellule progenitrici del muscolo (i mioblasti) si moltiplicano e, dopo essere migrate nel punto da riparare, si fondono tra loro per costituire nuove fibre muscolari.
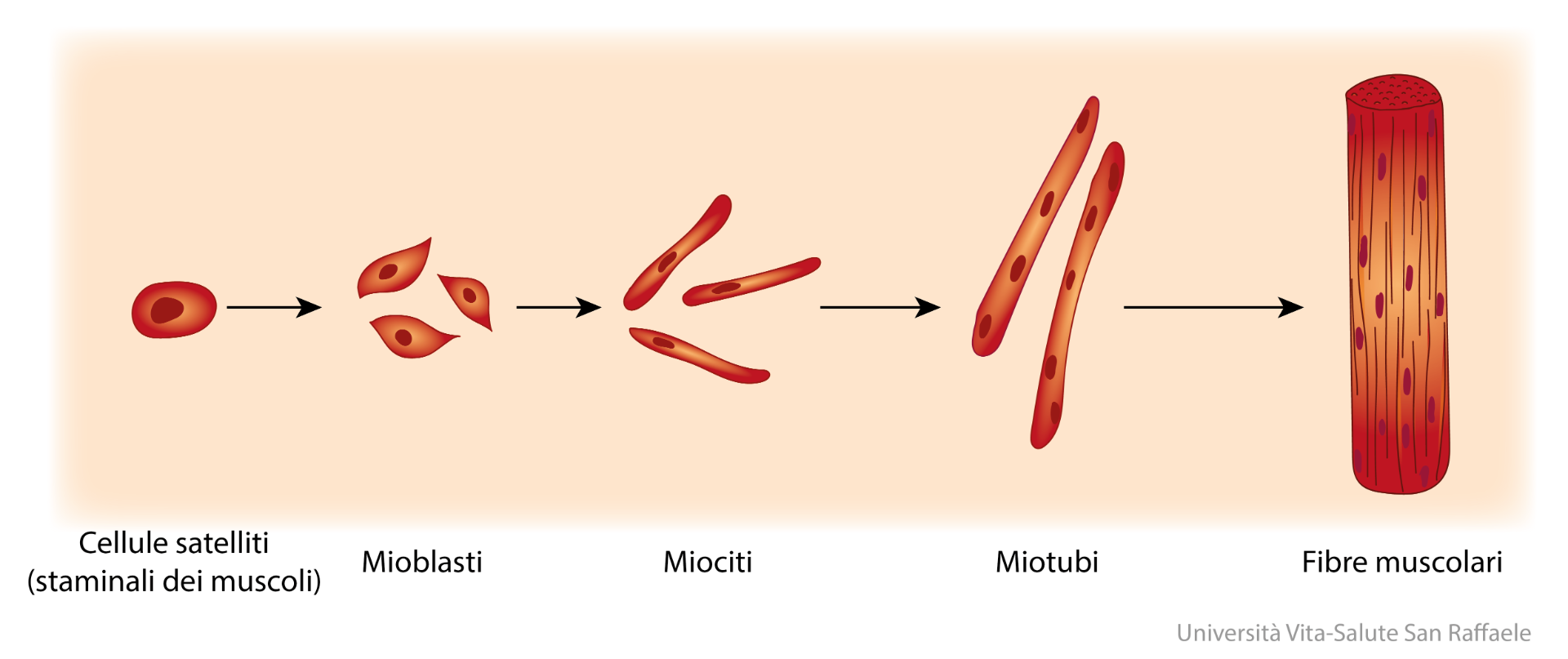
Sebbene questo processo – noto come fusione dei mioblasti – sia molto studiato e ben compreso a livello meccanico e molecolare, fino a oggi si è saputo poco sulla sua regolazione: quando e come viene attivato e perché a volte ciò non accade, con effetti patologici anche molto gravi? Ecco perché questo risultato è così rilevante. “Nell’ambiente dove si forma il muscolo sono presenti molti tipi cellulari diversi, come fibroblasti, adipociti, cellule dei vasi sanguigni. È essenziale che, una volta raggiunta la destinazione, le cellule muscolari siano in grado di riconoscere in maniera specifica i partner con i quali andare a fondere”.
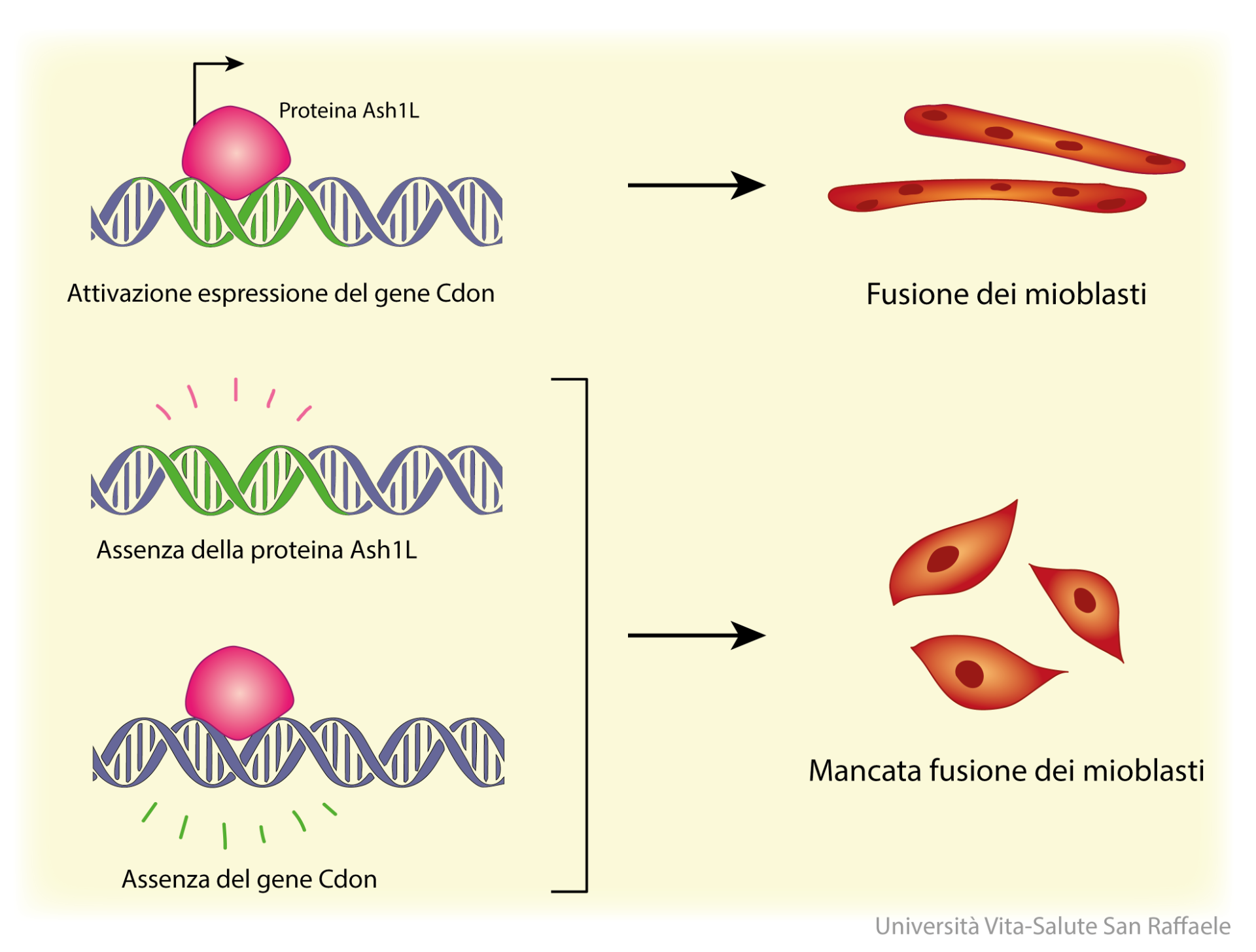
I ricercatori del San Raffaele hanno osservato che durante il processo di fusione dei mioblasti, all’interno delle cellule coinvolte, entra in azione una proteina chiamata Ash1L, un cosiddetto regolatore epigenetico: il suo lavoro è quello di attivare la trascrizione di altri geni, agendo come un vero e proprio interruttore che accende la traduzione del DNA in proteine. “Il coinvolgimento di Ash1L risulta fondamentale per il successo della fusione: nei topi a cui manca questa proteina lo sviluppo muscolare è ridotto; non solo, ma Ash1L risulta ridotto nei tessuti dei pazienti affetti da distrofia muscolare di Duchenne, nei quali la formazione del tessuto muscolare scheletrico è compromessa”, puntualizza il Dott. Gabellini.
Una volta osservata la correlazione tra il fenomeno della fusione dei mioblasti e l’espressione di Ash1L, i ricercatori si sono chiesti a cosa fosse collegato questo interruttore molecolare: qual è il gene che viene acceso da Ash1L ed è fondamentale per garantire il fenomeno di fusione dei mioblasti in fibre muscolari? Utilizzando tecniche di genomica avanzate, in collaborazione con il Centro di Genomica Traslazionale e Bioinformatica dell’IRCCS Ospedale San Raffaele di Milano, e incrociando i risultati con quello che già sappiamo di questo processo, il gruppo di Gabellini è riuscito a identificarlo: si chiama Cdon e gioca un ruolo nel riconoscimento reciproco dei mioblasti e nella loro adesione, entrambi fondamentali per permetterne la fusione.
“In collaborazione con altre proteine di membrana, Cdon svolge l’importante funzione di riconoscimento tra le cellule che devono fondersi tra loro per dare origine alle fibre muscolari. In assenza di Cdon (o del suo attivatore Ash1L), i mioblasti sono ancora in grado di duplicarsi, migrare dove serve e differenziarsi correttamente, ma non sono più capaci di unirsi tra loro”.
“La scoperta è significativa non solo perché ci aiuta a comprendere meglio i meccanismi all’origine di molte malattie muscolari, ma perché potrebbe fornire nuovi target terapeutici per migliorare i trattamenti disponibili e disegnarne di nuovi che aiutino il processo di formazione delle fibre muscolari”, conclude il Dott. Gabellini.
Ti potrebbero anche interessare

Sclerosi multipla, svolta nella ricerca: individuata una molecola che promuove la riparazione del sistema nervoso

Università Vita-Salute San Raffaele al top in Italia
Il microbioma come alleato contro il mieloma

