Strategie di un virus intelligente: ecco come HIV persiste nel sistema immunitario
Una ricercatrice entusiasta del suo lavoro e felice di stare esattamente dove sta: è l’impressione immediata che si ha incontrando Daniela Cesana, prima autrice di uno studio da poco pubblicato sulla prestigiosa rivista Nature Communications. La ricerca svela per la prima volta un meccanismo tramite cui il virus HIV induce alterazioni genetiche in un sottotipo di cellule del sistema immunitario, per sfruttarle come “serbatoio virale” e proliferare indisturbato.
Daniela è ricercatrice nell’Unità di Biosicurezza della terapia genica e mutagenesi inserzionale presso il San Raffaele-Telethon Institute for Gene Therapy (SR-Tiget) dell’Ospedale San Raffaele, dove lavora da anni per migliorare la sicurezza dei vettori retrovirali, cioè dei virus resi innocui, utili per aiutare a curare diverse malattie. In quest’intervista lei e il coordinatore dell’unità, il Dott. Eugenio Montini, ci hanno raccontato del loro studio e delle sue sorprendenti implicazioni.

Perché e come nasce l’idea di questa ricerca
“Lavoro al SR-Tiget da 12 anni” racconta la Dott.ssa Cesana “dove da sempre studio la biosicurezza dei vettori lentivirali [ottenuti per manipolazione genetica del virus HIV, N.d.R.]. Quando ho cominciato a lavorare al Tiget iniziavano ad essere segnalati i primi casi di leucemia nei bambini affetti da X-SCID, una grave malattia del sistema immunitario, che erano stati trattati con vettori simili, ma non identici, ai vettori lentivirali: il nostro compito era valutare come e perché i vettori allora utilizzati fossero stati causa di quella patologia. Da lì è nata la mia passione per lo studio della biosicurezza dei vettori: dove vanno a integrarsi nel DNA, come si distribuiscono nel genoma, e come sviluppare dei modelli sperimentali che ci permettano di valutare il livello di genotossicità, cioè di danno a livello genetico”. Nel corso degli anni, grazie al lavoro svolto nel laboratorio del Dott. Montini, la Dott.ssa Cesana e i suoi colleghi hanno acquisito un’amplissima quantità di conoscenze sulla sicurezza di questi vettori, con lo scopo di rendere la terapia genica sempre più sicura, che ha poi portato i vettori lentivirali ad essere utilizzati per trattare i pazienti.
Continua la Dott.ssa: “Qualche anno fa, leggendo diversi studi pubblicati su riviste scientifiche, ci siamo imbattuti in un articolo decisamente interessante. Un ricercatore giapponese aveva studiato le integrazioni di HIV nel genoma di pazienti infetti e sottoposti a terapia antiretrovirale: in ben 5 di loro aveva osservato che 2 geni, BACH2 e STAT5B, normalmente deputati al controllo della sopravvivenza e della proliferazione cellulare, erano particolarmente bersagliati da integrazioni di HIV. Nel 2007, all’epoca dello studio, questo risultato era stato solo classificato come ‘strano’, e non era stata data alcuna giustificazione al fenomeno. Data l’esperienza maturata nel campo della biosicurezza abbiamo subito notato che la peculiare distribuzione delle integrazioni era chiaramente non casuale e tipicamente associata ad eventi di attivazione genica causata da integrazioni di vettori genotossici”. Da qui i ricercatori si sono domandati: è possibile che anche HIV possa indurre l’attivazione di alcuni geni nelle cellule del sangue di pazienti infetti?
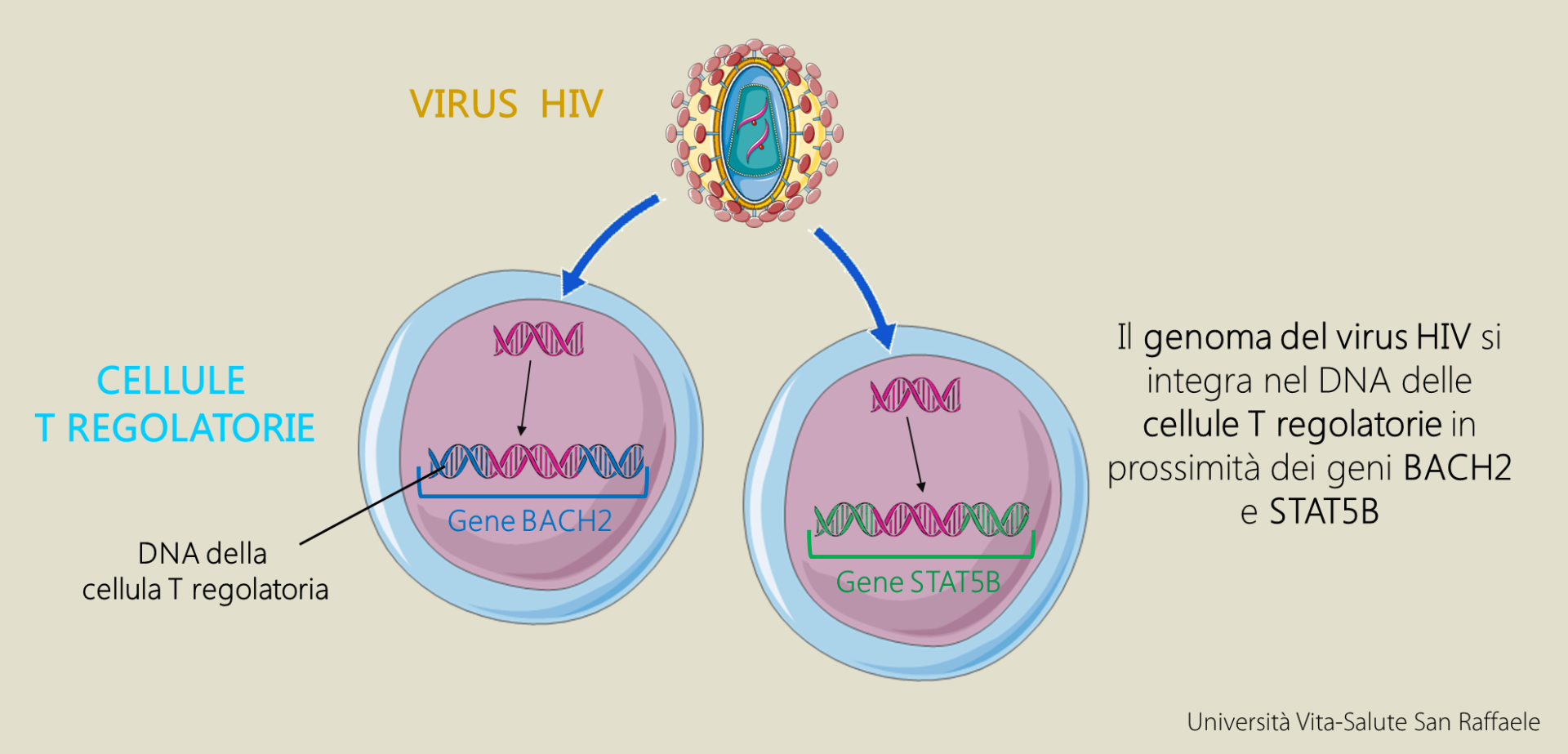
HIV introduce alterazioni genetiche nelle cellule T regolatorie
I ricercatori si sono dunque messi in contatto col Prof. Guido Poli, Ordinario di Patologia Generale, Università Vita-Salute San Raffaele e Capo dell’Unità “Immunopatogenesi dell’AIDS”, la Dr.ssa Elisa Vicenzi, Capo dell’Unità di Patogeni Virali e Biosicurezza e il Dott. Giuseppe Tambussi, Group Leader Clinico dell’Unità “Vaccini e immunoterapia delle malattie infettive” dell’ospedale San Raffaele. Spiega il Dott. Montini: “Abbiamo chiesto ai nostri colleghi di fornirci il DNA di cellule del sangue di pazienti affetti da HIV e abbiamo studiato le integrazioni del virus nel loro genoma. Anche in questa coorte di pazienti abbiamo osservato che BACH2 e STAT5B erano frequentemente colpiti da integrazioni di HIV, confermando le osservazioni descritte da studi precedenti. Inoltre, abbiamo potuto analizzare in dettaglio i diversi tipi di cellule del sangue di pazienti infetti e scoperto che questi geni erano stati attivati dal virus integrato nelle loro vicinanze e solo in un tipo di cellule molto speciale, le cellule T regolatorie”.
HIV sfrutta le cellule T regolatorie per nascondersi dal sistema immunitario
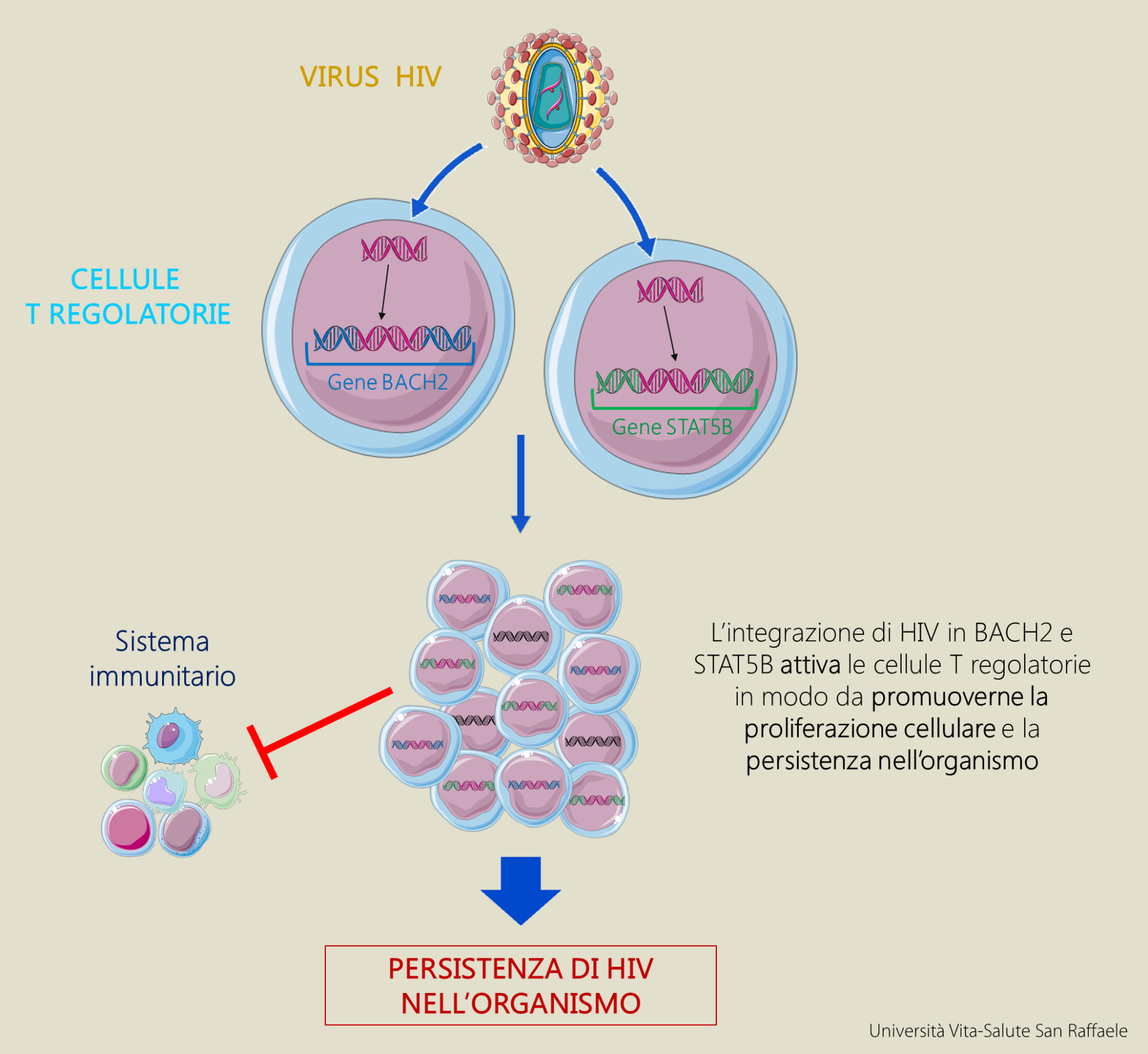
A differenza di altre cellule del sistema immunitario, che distruggono le cellule tumorali o infette da virus, le cellule T-regolatorie sono un particolare tipo di linfociti che hanno la funzione di tenere sotto controllo il sistema immunitario evitando così risposte eccessive potenzialmente pericolose per l’organismo. La domanda successiva che si sono posti i ricercatori è stata: cosa succede alle cellule T-regolatorie in cui i geni BACH2 o STAT5B sono attivati dalle inserzioni di HIV? Sfruttando le tecniche di terapia genica, i ricercatori hanno dimostrato che l’espressione di questi geni in cellule T-regolatorie induce la proliferazione cellulare e le rende longeve, permettendo di persistere a lungo nell’organismo, 10 anni e forse più.
Questa scoperta spiega, almeno in parte, come HIV riesca a sfuggire alla terapia antiretrovirale: nonostante esistano dei farmaci molto efficaci nell’abbattere l’infezione, il virus sfugge alla terapia “nascondendosi” in alcune cellule del sistema immunitario, che possono essere considerate come dei “santuari protettivi” che costituiscono un vero e proprio “serbatoio virale”. A causa di questo “serbatoio” la terapia non può essere interrotta, altrimenti il virus riemerge e il paziente viene reinfettato velocemente, e deve durare per tutta la vita con dei costi enormi a livello umano ed economico.
Aggiunge il Dott. Montini: “Il meccanismo descritto evidenzia come HIV non si limiti solo a nascondersi passivamente nelle cellule che costituiscono il serbatoio virale ma utilizzi meccanismi attivi di ingegneria genetica per farle espandere e prolungarne l’esistenza. Un aspetto affascinante è che l’attivazione di BACH2 o STAT5B tramite inserzioni di HIV conferisce un vantaggio selettivo solo a cellule T-regolatorie – apparentemente non altre – le quali sono degli agenti immunosoppressori. Questa scoperta fa sorgere il sospetto che queste cellule possano non soltanto fungere da serbatoio virale longevo ma addirittura bloccare l’attività del sistema immunitario contro il virus. Oltre ad essere interessante come ricerca di base, questa scoperta potrebbe dare importanti indicazioni, ad esempio, su come eliminare questa “riserva cellulare” e sviluppare approcci che interferiscano con la funzione dei geni attivati da HIV in nelle cellule T regolatorie”.
Le prospettive future
Conclude la Dott.ssa Cesana: “BACH2 e STAT5B potrebbero non essere gli unici geni che, attivati da HIV, conferiscono un vantaggio alla cellula ospite per favorire la persistenza dell’infezione. La prossima sfida è quella di identificare altri geni coinvolti in questo meccanismo con la speranza di ottenere, in futuro, l’eradicazione definitiva dell’infezione da HIV. Di certo questa storia non sarebbe stata possibile senza la preziosa e multidisciplinare collaborazione tra ricercatori e clinici: la grande professionalità di tutti i colleghi e l’ambiente decisamente collaborativo e costruttivo del San Raffaele e del SR-Tiget, come abbiamo sempre avuto modo di sperimentare, hanno permesso di raggiungere gli importanti risultati che raccontiamo oggi”.
Lo studio è stato reso possibile grazie ai finanziamenti della Fondazione Telethon, Giovani Ricercatori del Ministero della Salute e Grand Challenges Explorations della Bill and Melinda Gates Foundation.
Ti potrebbero anche interessare

Sclerosi multipla, svolta nella ricerca: individuata una molecola che promuove la riparazione del sistema nervoso

Università Vita-Salute San Raffaele al top in Italia
Il microbioma come alleato contro il mieloma

