Team del Prof. Casari fa nuova luce sulla forma di paraplegia spastica ereditaria SPG7
Chiarito il meccanismo molecolare e individuato un possibile approccio terapeutico per la forma di tipo 7
Chiarito il meccanismo patologico alla base di una rara malattia neurologica di origine genetica e individuato un potenziale approccio terapeutico: è quanto emerge da uno studio pubblicato su EBio Medicine dal team di Giorgio Casari, professore ordinario di Genetica medica presso UniSR e Direttore della Genomica Clinica dell’IRCCS Ospedale San Raffaele.
La paraplegia spastica ereditaria
La paraplegia spastica ereditaria è una malattia neurologica caratterizzata da progressiva spasticità e debolezza degli arti inferiori. Ad oggi sono noti circa 60 geni responsabili, quando difettosi, di una delle forme di questa patologia, che presenta notevole eterogeneità sia nell’età di insorgenza sia nella modalità di trasmissione, a seconda dello specifico gene coinvolto. Il primo gene in assoluto a essere stato associato a questa malattia è quello della paraplegina, una proteina localizzata nei mitocondri, le centrali energetiche delle nostre cellule: è stato proprio Casari a descriverlo sulle pagine della rivista Cell nel 1998, quando identificare geni-malattia era un processo molto più lungo e faticoso di oggi.

La forma di tipo 7 e il ruolo dei mitocondri
«La forma di tipo 7, o SPG7, non si discosta molto dalle altre a livello clinico, ma è invece davvero peculiare se si guarda al meccanismo che la provoca
spiega Casari, che da poco è stato anche nominato presidente del comitato scientifico dell’Associazione Italiana Vivere la Paraplegia Spastica (AiViPS).
Fin dall’inizio abbiamo compreso che nella patogenesi fossero coinvolti i mitocondri, le centrali energetiche delle nostre cellule dove questa proteina è localizzata, ma non era chiaro come e perché. In questi anni si è capito che i mitocondri, oltre a fornire energia alla cellula svolgono anche un ruolo chiave nel determinarne il destino in condizioni di stress. In questo senso, una struttura chiave è il poro di transizione della permeabilità mitocondriale (mPTP): dobbiamo immaginarla come la valvola di una pentola a pressione, che si apre all’occorrenza per far uscire il vapore quando la pressione interna supera un certo limite. Analogamente, questo complesso proteico si apre e si chiude in modo intermittente per regolare all’interno del mitocondrio la concentrazione di sostanze quali gli ioni calcio e le specie reattive dell’ossigeno, che va mantenuta bassa perché il mitocondrio funzioni. Nei neuroni questo è particolarmente rilevante perché la trasmissione dei segnali alla sinapsi avvenga correttamente».

La mutazione nella paraplegina e il complesso mPTP
Grazie alle tecnologie di microscopia e al supporto bioinformatico del Tigem – dove Casari si è temporaneamente trasferito dal 2016 al 2019 – i ricercatori hanno potuto letteralmente osservare in diretta le cellule di pazienti affetti da SPG7 e misurare l’attività di mPTP, la “valvola” dei mitocondri. Come spiegano le prime autrici del lavoro, Irene Sambri e Filomena Massa,
«abbiamo visto che, a causa della mutazione nella paraplegina, il complesso mPTP perde la sua capacità di aprirsi e chiudersi in modo “intelligente” e tende a rimanere chiuso, causando una disfunzione della trasmissione del segnale nervoso e un progressivo malfunzionamento dei neuroni coinvolti, promuovendo la neurodegenerazione. Questo non solo ha contribuito a chiarire a livello molecolare il meccanismo patologico alla base di questa forma di paraplegia spastica ereditaria, ma ci ha suggerito anche un possibile approccio terapeutico».
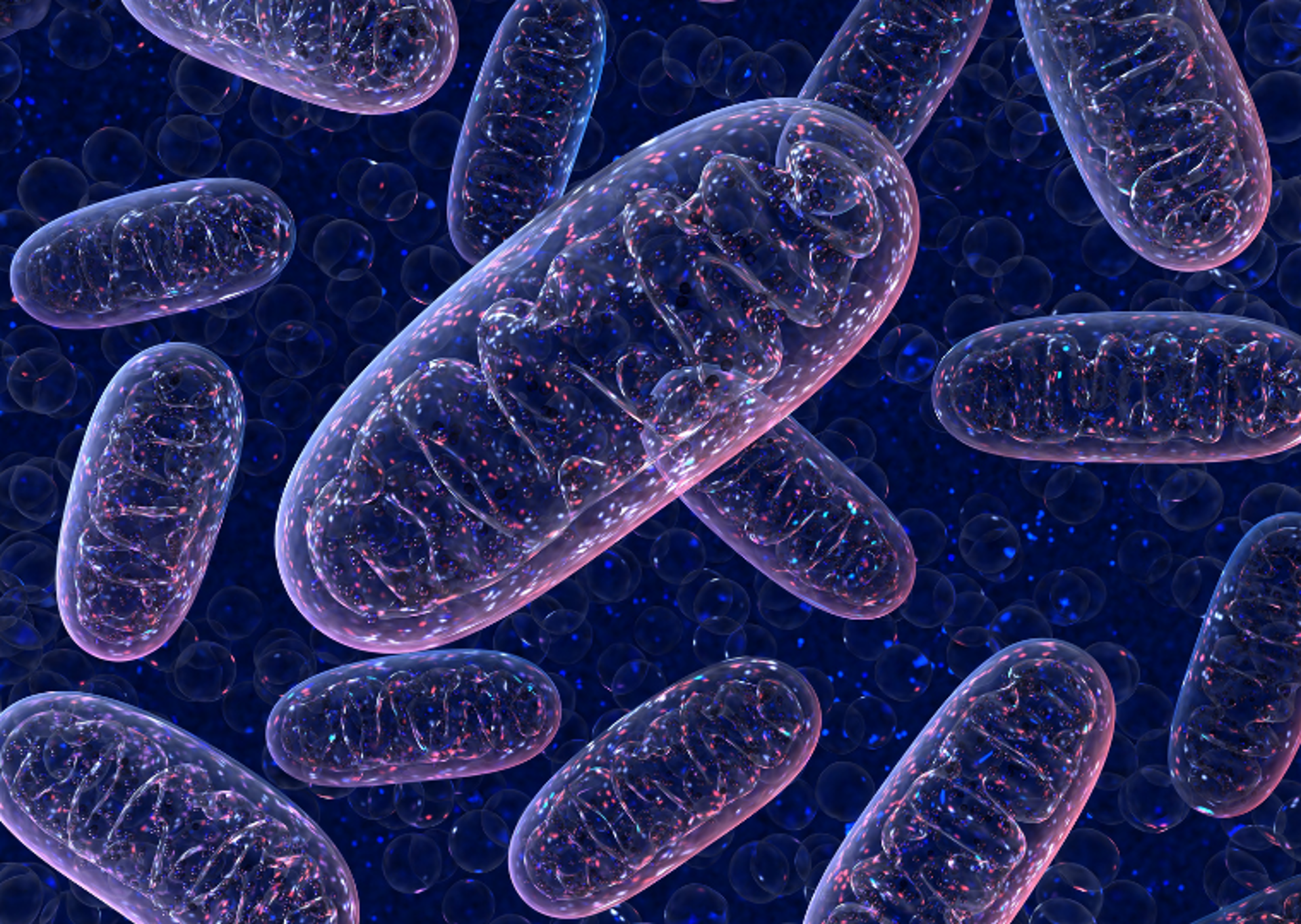
Ripristinare il funzionamento del complesso mPTP
Nel modello animale della malattia i ricercatori sono infatti riusciti a ripristinare il corretto funzionamento del complesso mPTP grazie alla somministrazione di un farmaco, la benzodiazepina Bz-423, in grado di risolvere la disfunzione causata da mutazioni di paraplegina: questo ha portato al recupero della normale trasmissione sinaptica nell’animale e soprattutto a un miglioramento significativo della sua capacità motoria, oltre che a una riduzione dell’infiammazione e neurodegenerazione tipiche di questa patologia.
«I risultati ottenuti dimostrano come la struttura mitocondriale mPTP rappresenti un bersaglio farmacologico promettente per la terapia di questa forma di paraplegia spastica e anche di altre malattie neurodegenerative che condividono lo stesso meccanismo molecolare di malattia»
conclude Casari.
Ti potrebbero anche interessare

Sclerosi multipla, svolta nella ricerca: individuata una molecola che promuove la riparazione del sistema nervoso

Università Vita-Salute San Raffaele al top in Italia
Il microbioma come alleato contro il mieloma

