Il Basic Science Award 2017 ad una ricerca UniSR: Margherita, nostra PhD, tra gli autori

La European Blood and Marrow Transplantation (EBMT) è la società di riferimento in Europa che si occupa di trapianto di midollo e raccoglie tutti i clinici, medici, ricercatori, trapiantologi di midollo europei; ogni anno assegna il Basic Science Award, un prestigioso riconoscimento per la ricerca di base nell’ambito del trapianto di sangue o midollo. Quest’anno il premio è stato assegnato al gruppo di ricerca del Dott. Attilio Bondanza, che è stato ricercatore presso l’Università Vita-Salute San Raffaele, medico trapiantologo e Principal Investigator dell’Unità “Immunoterapie Innovative”. Motivazione di questo riconoscimento è stata: “Per il contributo all’avanzamento della scienza trapiantologica e dell’immunoterapia genica del cancro”. Il gruppo, infatti, ha messo a punto un modello animale innovativo per studiare gli effetti dei linfociti CAR-T, che consente di ricapitolare esattamente ciò che accade durante la malattia nell’uomo: l’utilizzo dei CAR-T sull’uomo è in atto da anni, ma questo modello potrà essere usato per predire in maniera efficace quanto finora è stato osservato sull’uomo solo in via sperimentale.
Lo studio premiato è oggetto della tesi di Dottorato di Margherita Norelli, ex studentessa di Biotecnologie UniSR e ora Dottorata in Medicina Molecolare. In quest’articolo abbiamo chiesto alla Dott.ssa Norelli e il Dott. Bondanza di illustrarci in cosa consiste la loro ricerca.
COSA SONO LE CAR-T CELLS?
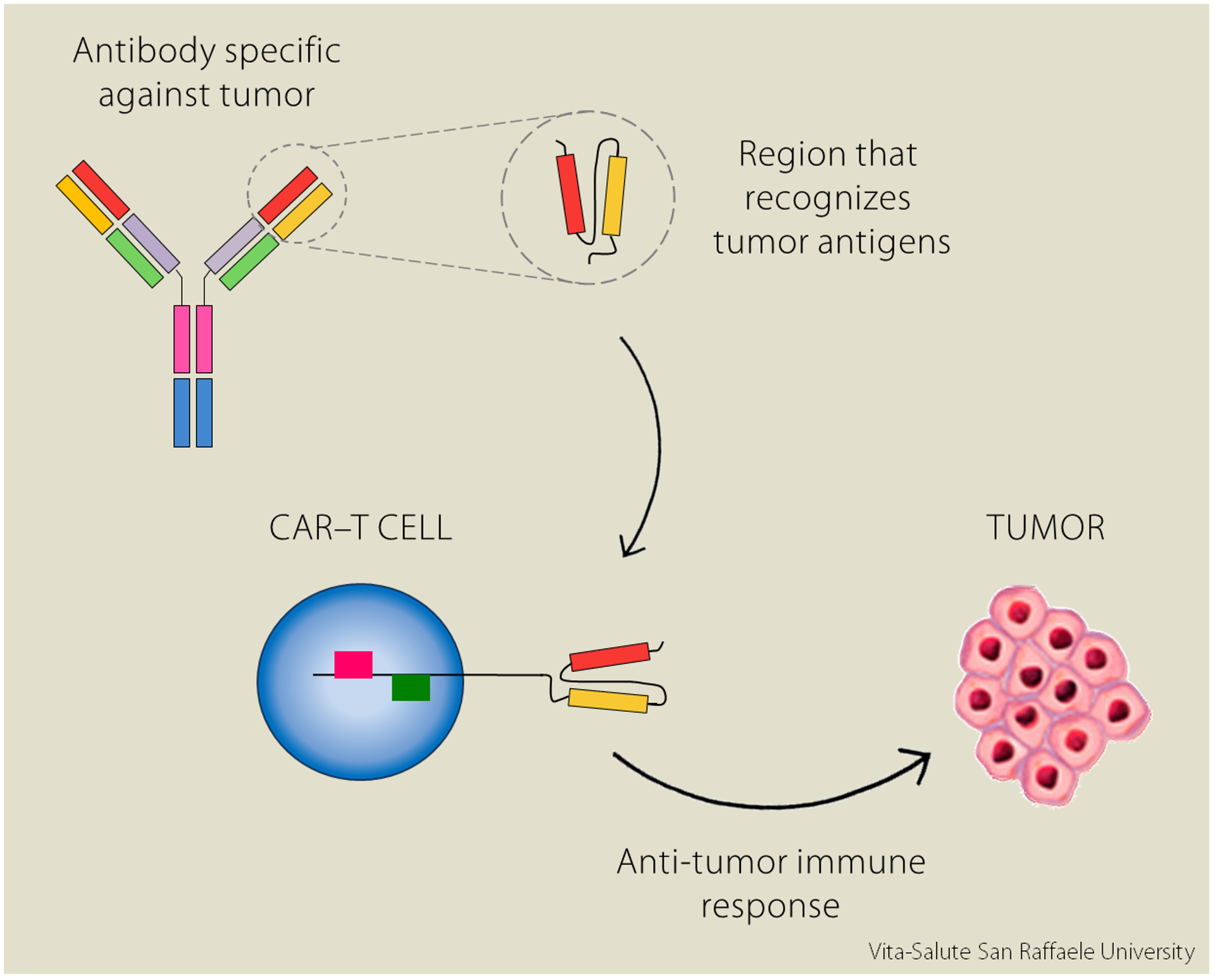
Alcune cellule del nostro sistema immunitario producono delle proteine dette anticorpi. Ogni anticorpo è specifico nel riconoscere un determinato patogeno, cioè una sostanza potenzialmente pericolosa; allo stesso modo esistono anche degli anticorpi in grado di riconoscere i tumori.
“In laboratorio” spiega la Dott.ssa Norelli “è possibile isolare le regioni variabili dell’anticorpo [in rosso e in arancione nell’immagine, N.d.R.], le parti che riconoscono in maniera estremamente specifica delle molecole espresse sulla superficie dei tumori”.
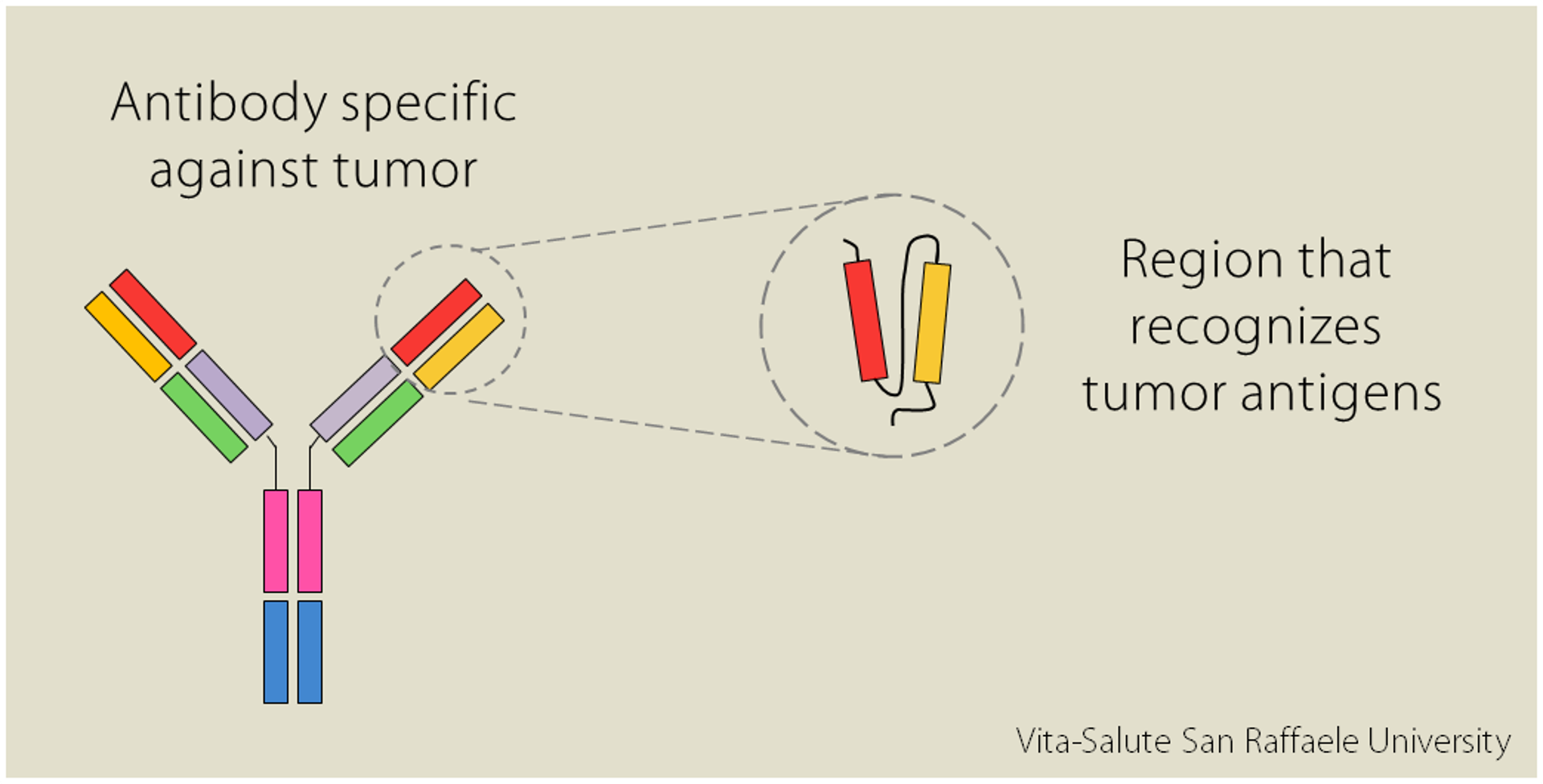
L’intuizione è stata quella di unire la specificità dell’anticorpo per riconoscere il tumore con l’efficacia dei linfociti T, le cellule del nostro sistema immunitario che attaccano le sostanze estranee: modificandoli, li si può “educare” a riconoscere gli organismi dannosi e potenziale la loro risposta difensiva. “Così è nata l’idea delle CAR-T cells: linfociti T modificati per esprimere recettori creati in laboratorio. La sigla “CAR” sta per Chimeric Antigen Receptors, recettori chimerici degli antigeni; sono detti “chimerici” perché sono composti da diversi elementi:
- la regione variabile, di origine anticorpale, che riconosce gli antigeni espressi dal tumore
- una regione spacer di collegamento
- dei domini di segnalazione all’interno del linfocita T”.
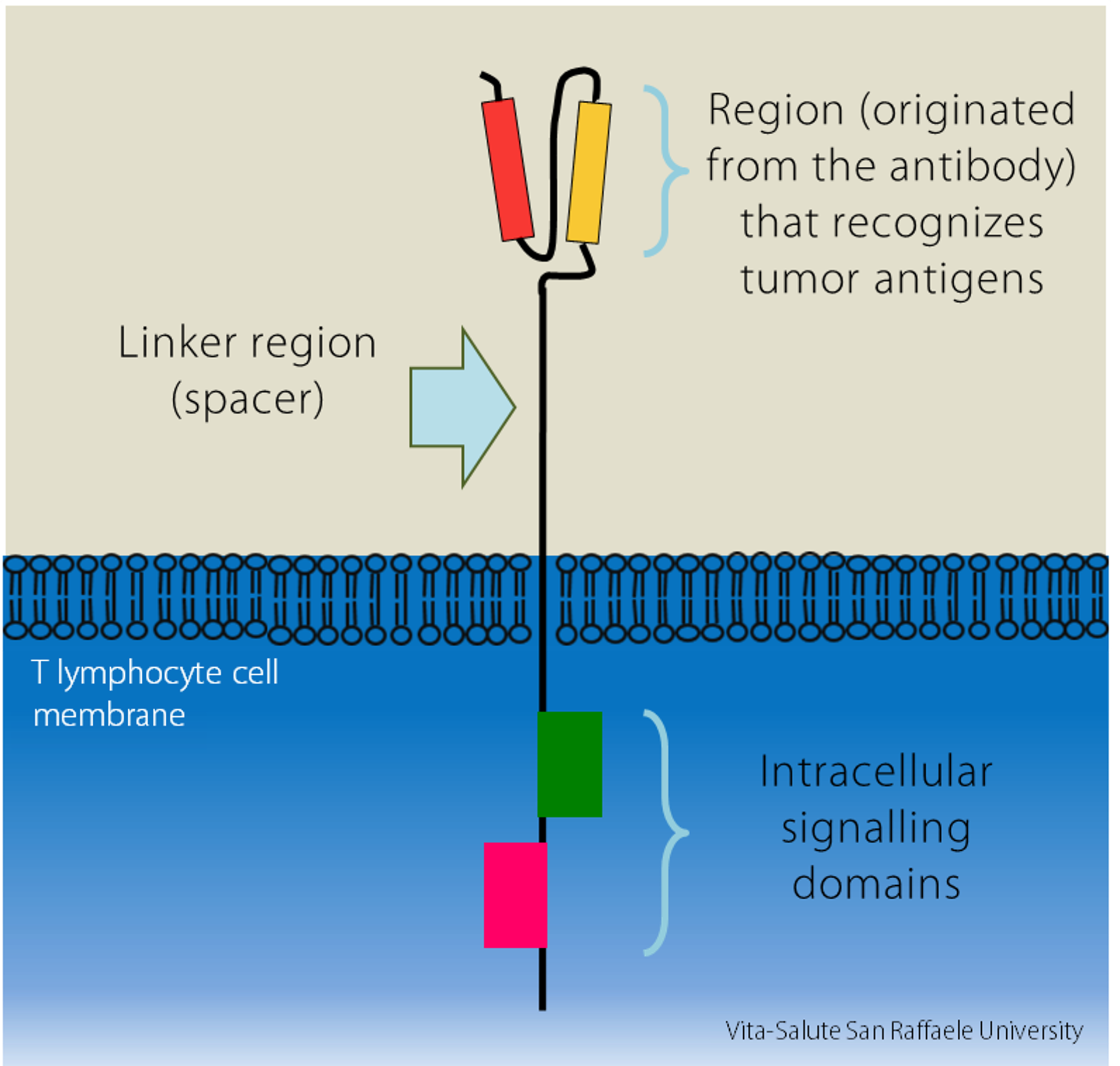
Le CAR-T cells sono quindi cellule geneticamente ingegnerizzate per esprimere il recettore chimerico sulla loro superficie, in modo che riconosca i tumori in maniera più specifica ed efficiente.
“Nello studio che noi abbiamo presentato al Congresso, abbiamo testato queste CAR-T cells su cellule di leucemia mieloide acuta (AML), un tumore del sangue”.
Sperimentazioni simili erano già state condotte negli Stati Uniti, usando delle CAR-T cells contro le leucemie delle cellule B. “Questi studi avevano però fatto emergere un evento inatteso: si era verificata una grave tossicità nei pazienti, chiamata cytokine-release syndrome (sindrome da rilascio di citochine, CRS)”. Tale effetto si scatena nel momento in cui i linfociti T riconoscono il tumore e rilasciano un’imponente quantità di citochine (molecole) proinfiammatorie.
QUAL È LA NOVITÀ DI QUESTA RICERCA?
L’interesse della Dott.ssa Norelli è stato quello di capire quale meccanismo molecolare provocasse questa violenta tempesta citochinica: per farlo ha generato un modello animale preclinico che fornisse le basi per poi migliorare la terapia sull’uomo.
“Molto spesso i risultati degli studi condotti sugli animali, una volta applicati in clinica, si rivelano inefficienti o non adeguati; la prima cosa che abbiamo fatto allora è stato generare un modello murino che avesse un sistema immunitario identico a quello umano. Questo modello è detto “umanizzato” perché il topo fa da ospite, quasi da “contenitore”, a cellule umane”.
Nello studio, i topi sono stati trapiantati con cellule staminali ematopoietiche umane [che daranno origine a tutto il sistema immunitario umano, N.d.R.], contemporaneamente iniettati con cellule tumorali umane e trattati con CAR-T cells di origine umana.
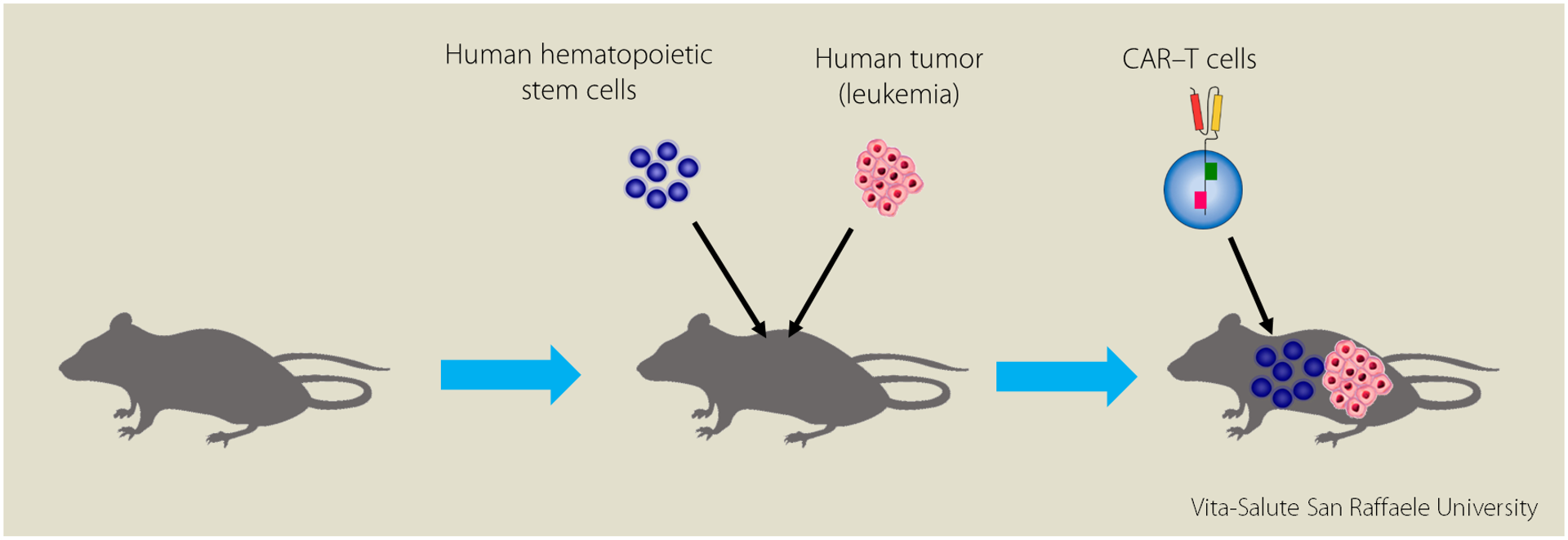
“Nonostante l’effetto negativo” continua la Dott.ssa, “questa tempesta citochinica sembrerebbe utile, se non addirittura in certi casi fondamentale, per dare una seconda attivazione ai T stessi e contribuire così all’eradicazione del tumore”.
Come fare allora ad ottenere l’effetto antitumorale senza generare la tossicità fatale per i pazienti?
“Abbiamo deciso di testare due farmaci (si chiamano Tocilizumab e Anakinra), già utilizzati in clinica per bloccare l’azione delle citochine infiammatorie: li abbiamo usati per valutare se riescono o meno a combattere la tossicità. Ad un gruppo di topi sono stati somministrati questi farmaci contemporaneamente all’infusione delle CAR-T cells; un secondo gruppo di topi ha fatto da controllo, e non hanno ricevuto i farmaci. Settimanalmente li abbiamo seguiti per valutare l’eventuale sviluppo della tossicità e lo stato del tumore”.
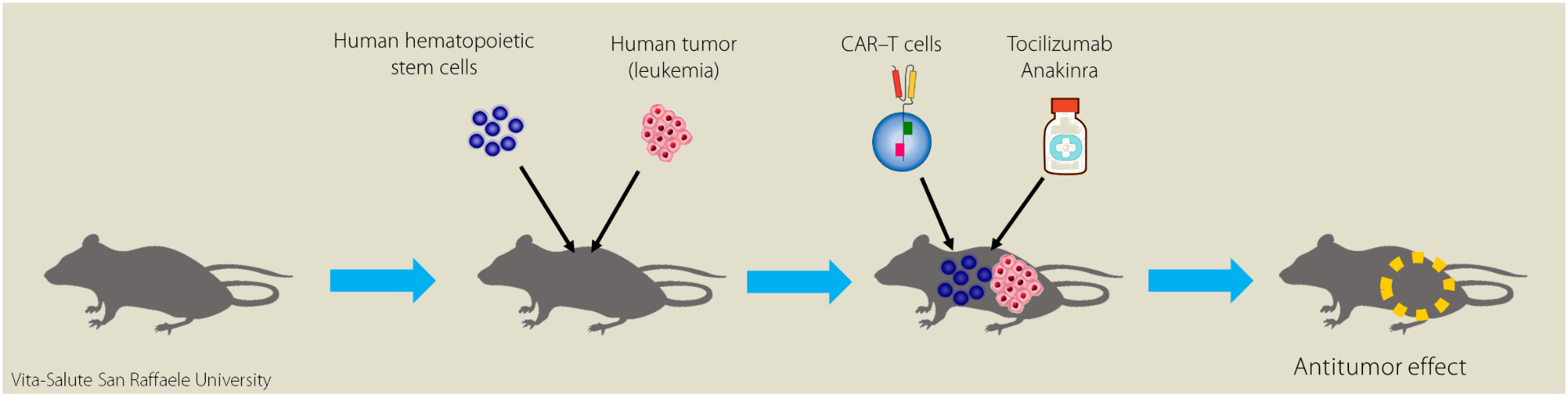
“Al termine dello studio” interviene il Dott. Bondanza “abbiamo osservato che topi che avevano ricevuto questi due farmaci in aggiunta alle CAR-T cells danno l’esito positivo di eradicazione del tumore senza provocare l’effetto negativo della tossicità. Questo approccio innovativo è una strategia importante per potenziare l’azione antitumorale senza inficiare l’attività delle CAR-T cells”.
“Questo tipo di studi non può essere condotto sull’uomo, per cui l’utilizzo dell’animale (che peraltro viene trattato con grande rispetto e in conformità al regolamento della Commissione Istituzionale per la Cura e l’Utilizzo degli Animali) purtroppo è necessario” conclude la Dott.ssa Barbara Camisa, fondamentale contributo per lo studio in vivo. “Solo in questo modo abbiamo potuto mimare realisticamente i meccanismi molecolari che avvengono nell’uomo, con il risultato che, utilizzando in via preventiva queste terapie, è possibile attenuare e abolire lo sviluppo della tossicità molto severa e mantenere a lungo l’effetto antitumorale”.
Dei risultati che ci fanno davvero ben sperare per il domani.
Ti potrebbero anche interessare

Giornata Mondiale delle Malattie Rare: ma la ricerca in UniSR continua tutto l’anno

Sclerosi multipla, svolta nella ricerca: individuata una molecola che promuove la riparazione del sistema nervoso

Università Vita-Salute San Raffaele al top in Italia