Il "termostato" dell'ossidazione cellulare: scoperto il meccanismo di chiusura dell'acquaporina
Ciascuna cellula del nostro corpo è in continuo “dialogo” con l’ambiente che la circonda: lo scambio di molecole è il mezzo più utilizzato per ricevere e dare informazioni. Le acquaporine, come si può facilmente intuire dal nome, sono pori (più precisamente, canali) integrati all’interno della membrana delle cellule, che consentono il passaggio di molecole d’acqua.
Una delle molecole coinvolte in diversi processi cellulari è l’acqua ossigenata (H2O2); normalmente questa non può diffondere liberamente attraverso la membrana, ma ha bisogno di canali specifici che ne facilitino l’ingresso e l’uscita dalla cellula. Molti studi in letteratura hanno recentemente suggerito che i membri della famiglia delle acquaporine potrebbero svolgere anche questa funzione: favorire il passaggio di acqua ossigenata.
Per le cellule, tuttavia, è importante controllare attentamente l’ingresso di questa molecola, che è un potente agente ossidante. A concentrazioni fisiologiche aiuta a mantenere l’equilibrio ossidativo della cellula, ma concentrazioni elevate di H2O2 possono alterare questo equilibrio, causando una situazione di stress ossidativo che provoca danni a diverse strutture intracellulari. Per questo motivo è essenziale che la cellula tenga sotto controllo la sua concentrazione intracellulare di H2O2.
La ricerca che raccontiamo aggiunge un importante tassello nello studio della regolazione del trasporto di acqua ossigenata e dello stress ossidativo. Protagonista di questo studio, pubblicato sulla prestigiosa rivista internazionale Science Advances, è acquaporina-8 (AQP8), canale appartenente alla famiglia delle acquaporine.
Autori principali della ricerca sono i ricercatori dell’Unità “Trasporto e secrezione delle proteine” coordinata da Roberto Sitia, Professore Ordinario di Biologia Molecolare presso l’Università Vita-Salute San Raffaele.
IL MECCANISMO DI CHIUSURA DELL’ACQUAPORINA
Racconta la Dott.ssa Iria Medraño-Fernandez, tra gli autori e coordinatori della ricerca: “In due studi precedente, avevamo dimostrato che i) AQP8 fosse in grado di trasportare H2O2 attraverso la membrana plasmatica, e ii) che questo canale fosse in grado di chiudersi reversibilmente in condizioni di stress cellulare. Nel presente studio abbiamo fatto un passo avanti, scoprendo il meccanismo responsabile della chiusura del canale”.
I passaggi chiave sono tre:
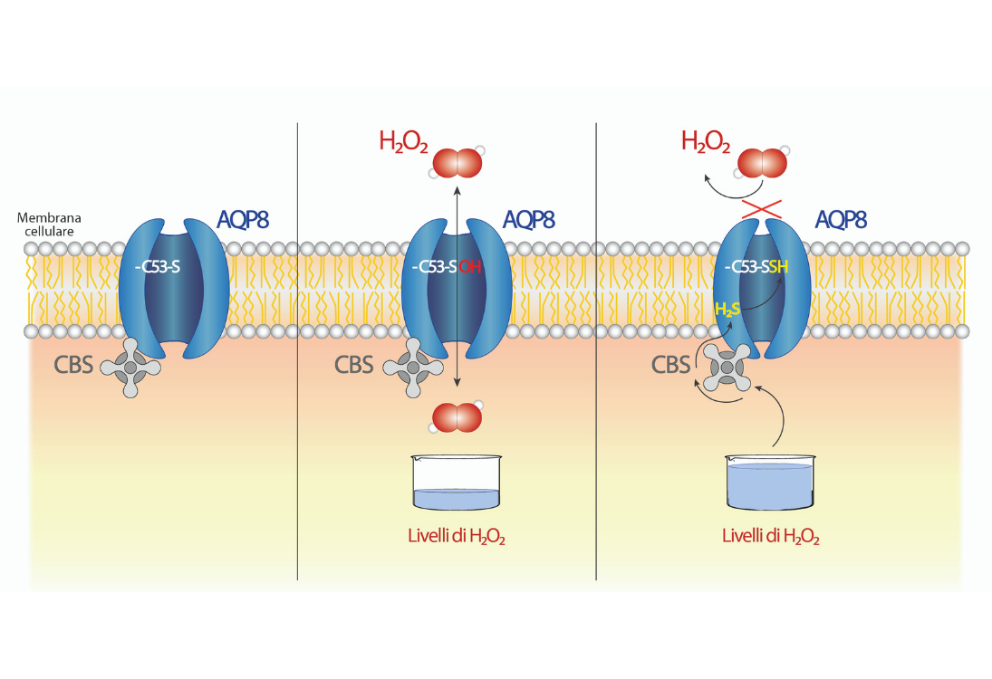
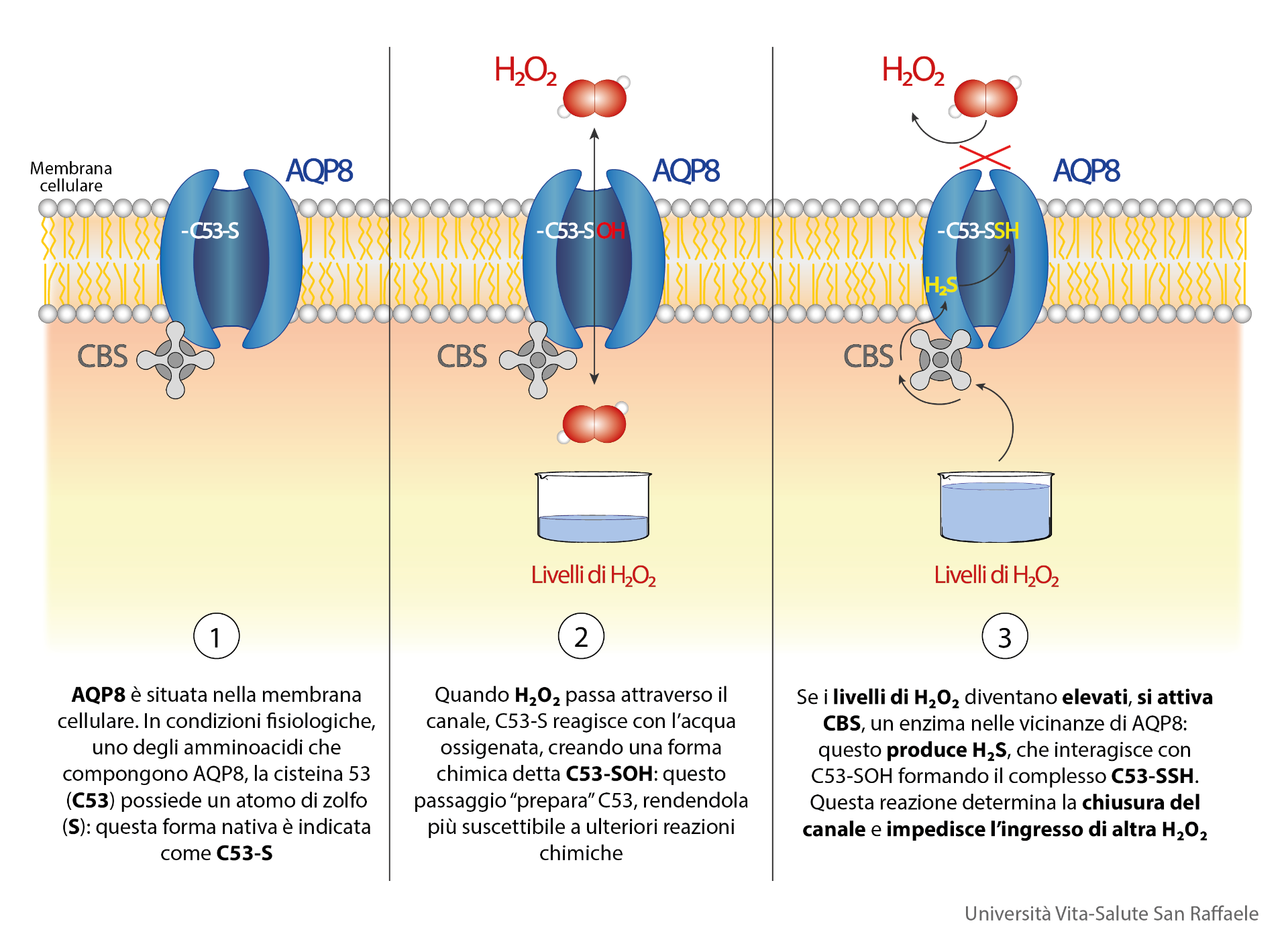
- AQP8 è situata nella membrana plasmatica, e consente il trasporto di molecole quali acqua e acqua ossigenata. In condizioni fisiologiche, uno degli amminoacidi [i “mattoncini”, N.d.R.] che compongono AQP8, la cisteina 53 (C53), possiede un atomo di zolfo (S) che – per la sua natura chimica e posizione strategica all’ingresso del canale – mostra particolare reattività verso gli agenti ossidanti che entrano mediante l’acquaporina.
- Nel momento in cui H2O2 passa attraverso il canale, la cisteina ridotta reagisce con l’acqua ossigenata, creando una forma chimica detta acido sulfenico (C53-SOH): questa ossidazione è fondamentale, perché “prepara” C53, rendendola più suscettibile a ulteriori reazioni chimiche.
- Quando i livelli di H2O2 crescono ulteriormente, come accade a cellule in stato di stress ossidativo, si attiva un enzima, la cistationina beta sintasi (CBS) che si trova nelle vicinanze dell’AQP8. Una funzione importante di CBS è la produzione di acido solfidrico (H2S), che interagisce con C53-SOH formando un complesso C53-SSH. Questa modificazione spinge un altro aminoacido assai voluminoso all’interno del canale determinandone la chiusura, e impedendo di conseguenza l’ingresso di altra acqua ossigenata.
Spiega il Dott. Stefano Bestetti, PostDoc presso l’Unità “Trasporto e secrezione delle proteine” e prima firma del lavoro: “Abbiamo trattato delle cellule in coltura con acido solfidrico (H2S) (pannello a sinistra). A seguito dell’aggiunta di H2O2 (pannello a destra), solo le cellule che esprimevano AQP8 C53S (una versione mutante della proteina, senza l’amminoacido-chiave per la regolazione, sostituito da una serina) importano acqua ossigenata; al contrario, quelle esprimenti AQP8 wt (“wild-type”, ovvero la versione “normale” della proteina) non hanno importato H2O2. Unitamente ad altri esperimenti che abbiamo condotto, questo ha dimostrato che il residuo C53 è il target principale di H2S e necessario per poter regolare l’ingresso di H2O2 nelle cellule”.
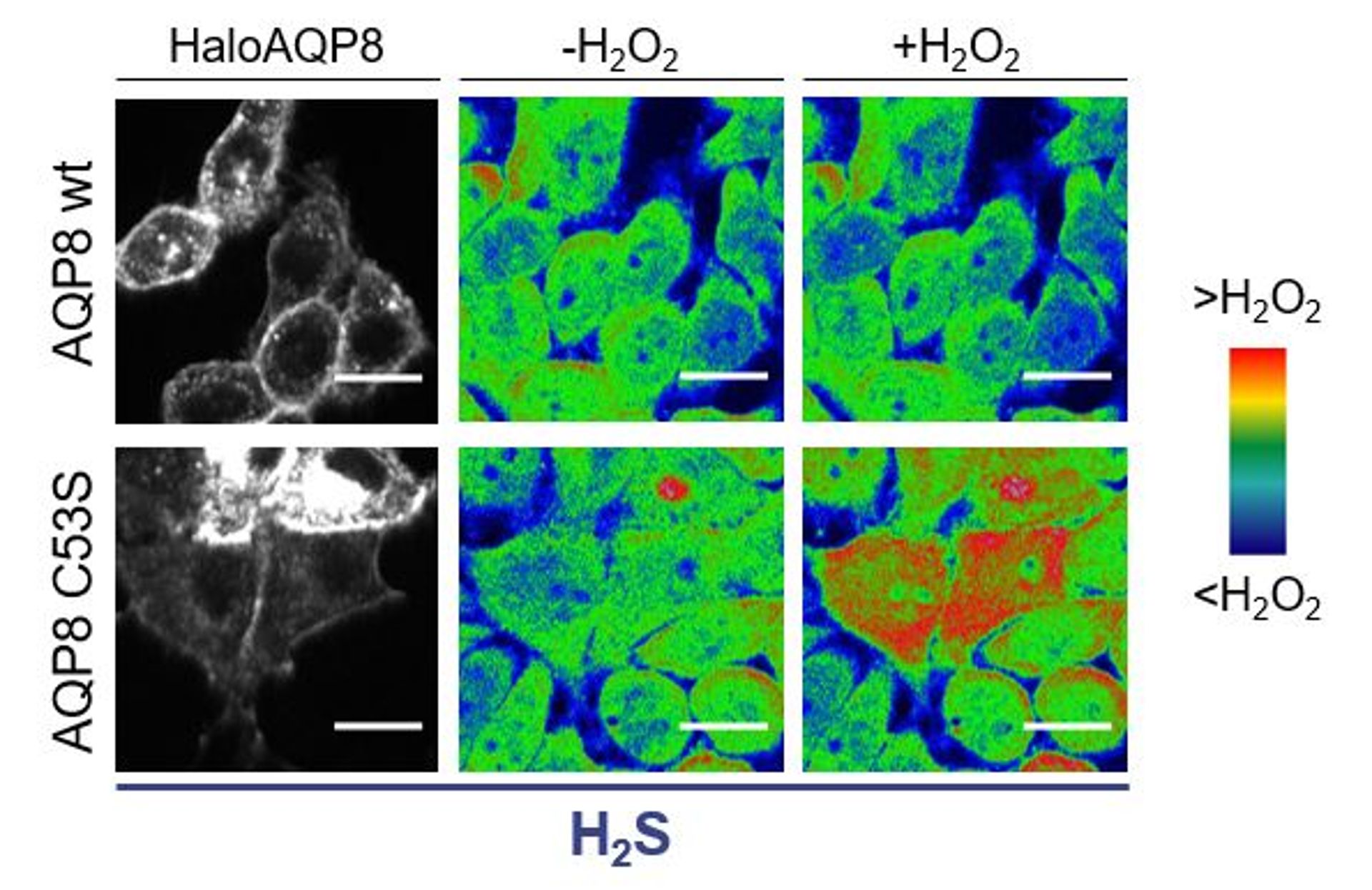
“Possiamo pensare a questo sistema come una sorta di “redox-stato”, cioè un “termostato” che controlla e regola lo stato ossidativo della cellula” chiarisce il Prof. Sitia.
Una volta che il canale è chiuso, in che modo viene ripristinata la permeabilità di AQP8? “La domanda non ha ancora una risposta certa” riflettono i ricercatori; “saranno necessari ulteriori ricerche per identificare le molecole coinvolte nei meccanismi di riapertura del canale”.
Osserva la Dott.ssa Medraño-Fernandez: “Il nostro studio ha identificato un nuovo meccanismo attraverso il quale le cellule integrano diversi segnali per adattarsi ai cambiamenti dell’ambiente. Riteniamo che sia un risultato importante, se si considera che questo potrebbe essere coinvolto in patologie quali tumore e infiammazioni croniche”.
Conferma infine il Prof. Sitia: “Sostituendo la C53 con una serina (che rispetto alla cisteina al posto dello zolfo ha un atomo di ossigeno), la AQP8 non è più regolabile durante lo stress. È di particolare interesse che cellule tumorali che esprimono questo mutante crescano più velocemente e siano maggiormente resistenti a chemioterapici o radiazioni. Tali osservazioni rendono questi risultati particolarmente rilevanti per l’oncologia molecolare, in quanto in numerosi tumori umani si riscontrano modificazioni che boicottano proprio questo meccanismo regolativo. Le molecole e le reazioni chimiche da noi identificate potrebbero rappresentare un nuovo target terapeutico per queste patologie”.

Tags:
Ti potrebbero anche interessare

Giornata Mondiale delle Malattie Rare: ma la ricerca in UniSR continua tutto l’anno

Sclerosi multipla, svolta nella ricerca: individuata una molecola che promuove la riparazione del sistema nervoso

Università Vita-Salute San Raffaele al top in Italia